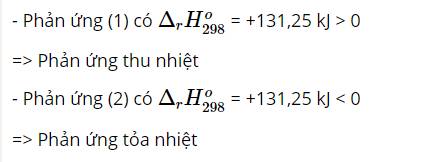Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hoá học
Các câu hỏi tương tự
Cho hai phương trình nhiệt hóa học sau:
CO(g) + ½ O2(g) → CO2(g) Δr\(H^0_{298}\) = -283,00 kJ (1)
H2(g) + F2(g) → 2HF(g) Δr\(H^0_{298}\) = -546,00 kJ (2)
So sánh nhiệt giữa hai phản ứng (1) và (2). Phản ứng nào xảy ra thuận lợi hơn?
Hãy làm cho nhà em sạch bong với hỗn hợp baking soda (NaHCO3) và giấm (CH3COOH). Hỗn hợp này tạo ra một lượng lớn bọt. Phương trình nhiệt hóa học của phản ứng:NaHCO3(s) + CH3COOH(aq) → CH3COONa(aq) + CO2(g) + H2O(l) ΔrH^0_{298} 94,30 kJPhản ứng trên là tỏa nhiệt hay thu nhiệt? Vì sao? Tìm những ứng dụng khác của phản ứng trên
Đọc tiếp
Hãy làm cho nhà em sạch bong với hỗn hợp baking soda (NaHCO3) và giấm (CH3COOH). Hỗn hợp này tạo ra một lượng lớn bọt. Phương trình nhiệt hóa học của phản ứng:
NaHCO3(s) + CH3COOH(aq) → CH3COONa(aq) + CO2(g) + H2O(l) Δr\(H^0_{298}\)= 94,30 kJ
Phản ứng trên là tỏa nhiệt hay thu nhiệt? Vì sao? Tìm những ứng dụng khác của phản ứng trên

Cho phản ứng sau:
S(s) + O2(g) \(\underrightarrow{t^o}\) SO2(g) Δf\(H^0_{298}\)(SO2,g) = -296,80 kJ/mol
Cho biết ý nghĩa của giá trị Δf\(H^0_{298}\)(SO2,g)

Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:N2(g) + O2(g) → 2NO(g) ΔrH^0_{298} +180 kJKết luận nào sau đây đúng?A. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấpB. Phản ứng tỏa nhiệtC. Phản ứng xảy ra thuận lợi ở điều kiện thườngD. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường
Đọc tiếp
Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2(g) + O2(g) → 2NO(g) Δr\(H^0_{298}\)= +180 kJ
Kết luận nào sau đây đúng?
A. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp
B. Phản ứng tỏa nhiệt
C. Phản ứng xảy ra thuận lợi ở điều kiện thường
D. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường
Cho phương trình nhiệt hóa học sau:
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l) Δr\(H^0_{298}\)= -57,3 kJ
Vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng.
Quan sát Hình 13.5, mô tả sơ đồ biểu diễn biến thiên enthalpy của phản ứng. Nhận xét về giá trị của Δf\(H^0_{298}\)(sp) so với Δf\(H^0_{298}\) (cđ).
Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ dưới. Kết luận nào sau đây là đúng?
A. Phản ứng tỏa nhiệt
B. Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng chất sản phẩm
C. Biến thiên enthalpy của phản ứng là a kJ/mol
D. Phản ứng tỏa nhiệt .

Phương trình nhiệt hóa học cho biết thông tin gì về phản ứng hóa học.
Viết phương trình hóa học của phản ứng xảy ra ở Hình 13.1 và nêu nhận xét về sự thay đổi nhiệt của phản ứng đó.