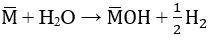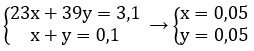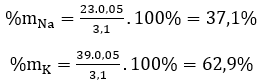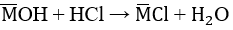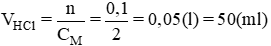Cho 3,1 gam hỗn hợp gồm hai kim loại kiềm ở hai chu kì kế tiếp nhau trong bảng tuần hoàn tác dụng hết với nước thu được 1,12 lít H2 ở đktc và dung dịch kiềm.
a) Xác định tên hai kim loại đó và tính thành phần phần trăm khối lượng mỗi kim loại.
b) Tính thể tích dung dịch HCI 2M cần dùng để trung hoà dung dịch kiềm và khối lượng hỗn hợp muối clorua thu được.
a) Gọi công thức chung của 2 kim loại kiềm là M
2M + 2H2O → 2MOH + H2
nH2nH2 = 0,05 mol ⇒ nM= 2nH2 =0,1 mol
⇒ M = 3,1/0,1= 31 (g/mol); Vậy 2 kim loại đó là Na (23) và K (39)
Gọi x là số mol kim loại Na, ⇒ nK = 0,1 – x (mol)
ta có: m hỗn hợp = mNa + mK
⇔ 3,1 = 23x + 39(0,1 - x)
⇒ x = 0,05 mol
%mNa=mNa/mhh*100%=23*0,05/3,1*100%*100%= 37,1%;
% mK = 100% - 37,1% = 62,9%.
b) HCl + MOH → MCl + H2O
nHCl =nMOH = 0,1 mol ⇒Vdung dịch HCl = n/CM=0,1/2=0,05lítnCM=0,12=0,05lí
mhh muối= mKL + mCl= 3,1 + 35,5.0,1= 6,65 (gam)
a. Gọi công thức chung cho hai kim loại kiềm là M
Số mol H2: nH2 = 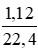
PTHH:
Theo pt: nM = 2. nH2 = 2. 0,05 = 0,1(mol)
⇒ M = 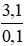
Gọi x, y lần lượt là số mol của Na và K trong hỗn hợp
Theo bài ra ta có hệ phương trình:
b.
Theo pt: nHCl = nMOH = 0,1 (mol)
m(MCl) = 0,1.(31 + 35,5) = 6,65(g)