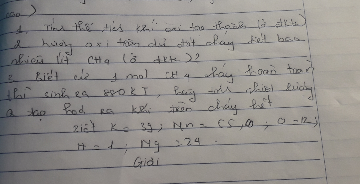Bài 6: Một bình phản ứng chứa 33,6 lít khí oxi (đktc). với thể tích này có thể đốt cháy:
a. Bao nhiêu gam cacbon?
b. Bao nhiêu gam hiđro
c. Bao nhiêu gam lưu huỳnh
d. Bao nhiêu gam photpho
Bài 7: Hãy cho biết 3. 1024 phân tử oxi có thể tích là bao nhiêu lít?
Bài 8: Tính thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 1 kg than đá chứa 96% cacbon và 4% tạp chất không cháy.
Bài 9: Đốt cháy 6,2 gam photpho trong bình chứa 6,72 lít khí oxi (đktc) tạo thành điphotpho pentaoxit.
a. Chất nào còn dư sau phản ứng, với khối lượng là bao nhiêu?
b. Tính khối lượng sản phẩm tạo thành.
Bài 10: Đốt cháy quặng kẽm sun fua (ZnS) , chất này tác dụng với oxi tạo thành kẽm oxit và khí sunfurơ. Nếu cho 19,4 gam ZnS tác dụng với 8,96 lít khí oxi (đktc) thì khí sunfurơ có thể sinh ra là bao nhiêu?
Bài 11: cho 32,5 gam Zn tác dụng vừa đủ với dd HCl, tính thể tích khí hiđro sinh ra (đktc)
Bài 12: Trong phòng thí nghiệm người ta điều chế oxit sắt từ Fe3O4 theo phương trình phản ứng sau: Fe + O2 → Fe3O4
a. Tính số gam sắt và thể tích oxi cần dùng để có thể điều chế được 2,32 gsm oxit sắt từ
b. Tính số gam Kali pemanganat KMnO4 cần dùng để có được lượng oxi dùng cho phản ứng trên. Biết KMnO4 nhiệt phân theo PTHH: 2KMnO4 → K2MnO4 + MnO2 + O2
Bài 13: Đốt cháy 21 gam một mẫu sắt không tinh khiết trong oxi dư người ta thu được 23,2 gam oxit sắt từ Fe3O4 . Tính độ tinh khiết của mẫu sát đã dùng
Bài 14: Cho các chất khí sau: Nitơ, cacbon đioxit, neon (Ne), oxi, metan (CH4)
a. Khí nào làm than hồng cháy sáng? Viết PTHH
b. Khí nào làm đục nước vôi trong? Viết PTHH
c. Khí nào làm tắt ngọn nén đang cháy?
d. Khí nào trong các khí trên là khí cháy? Viết PTHH
Bài 14:
a) Khí oxi làm than hồng cháy sáng
PTHH: C + O2 -to-> CO2
b) Khí CO2 làm đục nước vôi trong
PTHH: CO2 + Ca(OH)2 -> CaCO3 + H2O
Bài 13: Đốt cháy 21 gam một mẫu sắt không tinh khiết trong oxi dư người ta thu được 23,2 gam oxit sắt từ Fe3O4 . Tính độ tinh khiết của mẫu sát đã dùng
---
PTHH: 3 Fe + 2 O2 -to-> Fe3O4
0,3_________0,2_____0,1(mol)
nFe3O4= 23,2/232=0,1(mol)
=> mFe(p.ứ)= 0,3.56=16,8(g)
Độ tinh khiết của mẩu sắt: (16,8/21).100=80%
___________
Bài 12: Trong phòng thí nghiệm người ta điều chế oxit sắt từ Fe3O4 theo phương trình phản ứng sau: Fe + O2 → Fe3O4
a. Tính số gam sắt và thể tích oxi cần dùng để có thể điều chế được 2,32 gam oxit sắt từ
b. Tính số gam Kali pemanganat KMnO4 cần dùng để có được lượng oxi dùng cho phản ứng trên. Biết KMnO4 nhiệt phân theo PTHH: 2KMnO4 → K2MnO4 + MnO2 + O2
-----
a) 3 Fe + 2 O2 -to-> Fe3O4
0,03__0,02_______0,01(mol)
nFe3O4= 2,32/232= 0,01(mol)
=> mFe= 0,03.56=1,68(g)
V(O2,đktc)=0,02.22,4= 0,448(l)
b)2KMnO4 → K2MnO4 + MnO2 + O2
0,04___________0,02_0,02____0,02(mol)
=> mKMnO4= 158.0,04= 6,32(g)
____________
Bài 11: cho 32,5 gam Zn tác dụng vừa đủ với dd HCl, tính thể tích khí hiđro sinh ra (đktc)
---
nZn= 32,5/65= 0,5(mol)
PTHH: Zn + 2 HCl -> ZnCl2 + H2
0,5______1________0,5______0,5(mol)
=>V(H2,đktc)=0,5.22,4=11,2(l)
____________
Bài 10: Đốt cháy quặng kẽm sun fua (ZnS) , chất này tác dụng với oxi tạo thành kẽm oxit và khí sunfurơ. Nếu cho 19,4 gam ZnS tác dụng với 8,96 lít khí oxi (đktc) thì khí sunfurơ có thể sinh ra là bao nhiêu?
---
nO2= 8,96/22,4=0,4(mol)
nZnS= 19,4/ 97=0,2(mol)
PTHH:: ZnS + 3/2 O2 -to-> ZnO + SO2
Ta có: 0,4:1,5 > 0,2/1
-> O2 dư, ZnS hết, tính theo nZnS
=> nSO2= nZnS= 0,2(mol) => V(SO2,đktc)= 0,2.22,4=4,48(l)
_____________
Bài 9: Đốt cháy 6,2 gam photpho trong bình chứa 6,72 lít khí oxi (đktc) tạo thành điphotpho pentaoxit.
a. Chất nào còn dư sau phản ứng, với khối lượng là bao nhiêu?
b. Tính khối lượng sản phẩm tạo thành.
----
a) nP= 6,2/31= 0,2(mol)
nO2= 6,72/22,4= 0,3(mol)
PTHH: 4P + 5 O2 -to-> 2 P2O5
Ta có: 0,2/ 4< 0,3/5 => P hết, O2 dư, tính theo nP
nO2(dư) = 0,3 - 5/4. 0,2= 0,05(mol)
=> mO2(dư)= 0,05.32=1,6(g)
b) nP2O5= 2/4. nP= 2/4 . 0,2= 0,1(mol)
=> m(sản phẩm)= mP2O5= 142.0,1= 14,2(g)
__________
Bài 8: Tính thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 1 kg than đá chứa 96% cacbon và 4% tạp chất không cháy.
------
nC= 1.0,96= 0,96(kg)= 960(g) => nC= 960/12= 80(mol)
PTHH: C + O2 -to-> CO2
80_________80__80(mol)
=> V(O2,đkct)= 80.22,4=1792(l)
__________________
Bài 7: Hãy cho biết 3. 1024 phân tử oxi có thể tích là bao nhiêu lít?
--
nO2= (3.1024)/(6.1023)=5(mol)
=> V(O2,đktc)= 5.22,4= 112(l)
_________
Bài 6: Một bình phản ứng chứa 33,6 lít khí oxi (đktc). với thể tích này có thể đốt cháy:
a. Bao nhiêu gam cacbon?
b. Bao nhiêu gam hiđro
c. Bao nhiêu gam lưu huỳnh
d. Bao nhiêu gam photpho
------
nO2=33,6/22,4= 1,5(mol)
a) C+ O2 to-> CO2
1,5__1,5______1,5(mol)
mC= 1,5.12= 18(g)
b) H2 + 1/2 O2 -to-> H2O
3______1,5____3(mol)
mH2= 3.2= 6(g)
c) S + O2 -to-> SO2
1,5__1,5______1,5(mol)
=> mS = 1,5.32= 48(g)
d) 4 P + 5 O2 -to-> 2 P2O5
1,2______1,5____0,6(mol)
=> mP= 31.1,2= 37,2(g)
Bài 6: Một bình phản ứng chứa 33,6 lít khí oxi (đktc). với thể tích này có thể đốt cháy:
n O2=33,6/22,4=1,5(mol)
a. C+O2---->CO2
1,5<--1,5(mol)
m C=1,5.12=18(g)
b. 2H2+O2--->2H2O
3<----1,5(mol)
m H2=3.2=6(g)
c. S+O2--->SO2
1,5---1,5(mol)
m S=1,5.32=48(g)
d. 4P+5O2--->2P2O5
1,2<--1,5(mol)
m P=1,2.31=37,2(g)
Bài 7: Hãy cho biết 3. 1024 phân tử oxi có thể tích là bao nhiêu lít?
n O2=\(\frac{3.10^{24}}{6.10^{23}}=5\left(mol\right)\)
V O2=5.22,4=112(l)
Bài 8: Tính thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 1 kg than đá chứa 96% cacbon và 4% tạp chất không cháy.
m than đá nguyên chất = 1.96%=0,96(kg)=960(g)
n C=960/12=80(mol)
C+O2--->CO2
80--80
V O2=80.22,4=1792(l)
Bài 9: Đốt cháy 6,2 gam photpho trong bình chứa 6,72 lít khí oxi (đktc) tạo thành điphotpho pentaoxit.
a. Chất nào còn dư sau phản ứng, với khối lượng là bao nhiêu?
b. Tính khối lượng sản phẩm tạo thành.
a) 4P+5O2---->2P2O5
n P=6,2/31=0,2(mol)
n O2=6,72/22,4=0,3(mol)
-->O2 dư
n O2=5/4n P=0,25(mol)
n O2 dư=0,05(mol)
m O2 dư=0,05.32=1,6(g)
b)n P2O5=1/2n P=0,1(mol)
m P2O5=0,1.142=14,2(g)
Bài 10: Đốt cháy quặng kẽm sun fua (ZnS) , chất này tác dụng với oxi tạo thành kẽm oxit và khí sunfurơ. Nếu cho 19,4 gam ZnS tác dụng với 8,96 lít khí oxi (đktc) thì khí sunfurơ có thể sinh ra là bao nhiêu?
ZnS+O2--->Zn+SO2
n ZnS=19,4/97=0,2(mol)
n O2=8,96/22,4=0,4(mol)
-->O2 dư
n SO2=n ZnS=0,2(mol)
V SO2=0,2.22,4=4,48(l)
Bài 11: cho 32,5 gam Zn tác dụng vừa đủ với dd HCl, tính thể tích khí hiđro sinh ra (đktc)
n Zn=32,5/65=0,5(mol)
Zn+2HCl---->ZnCl2+H2
0,5-----------------------0,5
V H2=0,5.22M4=11,2(l)
Bài 12: Trong phòng thí nghiệm người ta điều chế oxit sắt từ Fe3O4 theo phương trình phản ứng sau: Fe + O2 → Fe3O4
a. Tính số gam sắt và thể tích oxi cần dùng để có thể điều chế được 2,32 gsm oxit sắt từ
b. Tính số gam Kali pemanganat KMnO4 cần dùng để có được lượng oxi dùng cho phản ứng trên. Biết KMnO4 nhiệt phân theo PTHH: 2KMnO4 → K2MnO4 + MnO2 + O2
3Fe+2O2--->Fe3O4
n FE3O4=2,32/232=0,01(mol)
n Fe=3n Fe3O4=0,03(mol)
m Fe=0,03.56=3,36(g)
n O2=2n Fe3O4=0,02(mol)
V O2=0,02.22,4=0,448(l)
b) 2KMnO4--->K2MnO4+MnO2+O2
0,04----------------------------------0,02(mol)
m KMnO4=0,04.158=6,32(g)
Bài 13: Đốt cháy 21 gam một mẫu sắt không tinh khiết trong oxi dư người ta thu được 23,2 gam oxit sắt từ Fe3O4 . Tính độ tinh khiết của mẫu sát đã dùng
3Fe+2O2--->Fe3O4
n Fe3O4=23,2/232=0,1(mol)
n Fe=3n Fe3O4=0,3(mol)
m Fe dùng =0,3.56=16.8(g)
độ tinh khiết=16,8/21.100%=80%