Áp dụng phương trình Arrhenius dạng vi phân ta có:
\(\dfrac{dlnK}{dT}=\dfrac{E_a}{RT^2}\\ \Leftrightarrow\dfrac{18963}{T^2}-\dfrac{2}{T.ln10}=\dfrac{E_a}{RT^2}\\ \Leftrightarrow E_a=\left(18963-\dfrac{2T}{ln10}\right)R\)
Lấy R = 8,314 (J/molK), thay T = 800K, ta được
\(E_a=\left(18963-\dfrac{2.800}{ln10}\right).8,314=1,52.10^5\) (kJ/mol)
#TúHoàngVũ
#HUST
#VĩnhLạc1











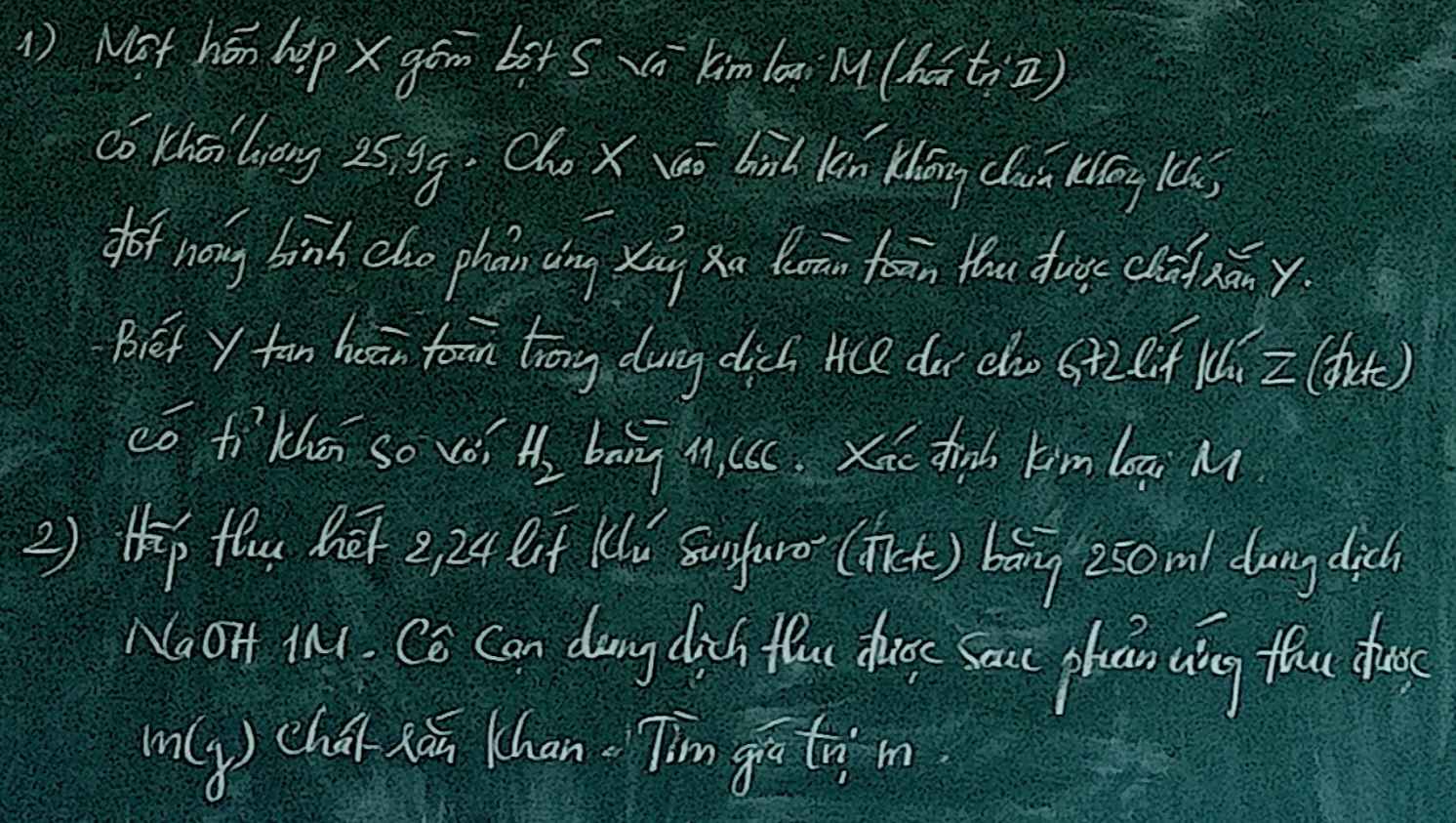

 Mn giúp mình câu 2 với ạ😭😭
Mn giúp mình câu 2 với ạ😭😭