Bài 25: Ankan
Nội dung lý thuyết
Các phiên bản khácI. GIỚI THIỆU VỀ ANKAN
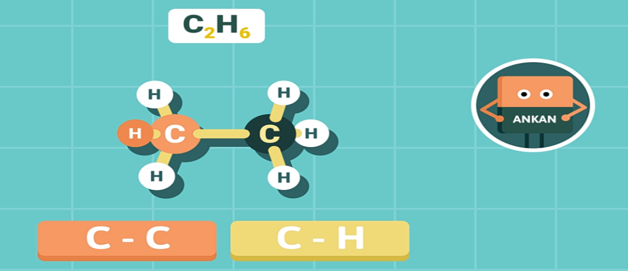
- Định nghĩa: Ankan là hidrocacbon no, mạch hở, trong phân tử gồm các liên kết đơn C-C và C-H.
- Mỗi nguyên tử cacbon tạo được 4 liên kết đơn hướng từ nguyên tử C (nằm ở tâm của hình tứ diện) về 4 đỉnh của một tứ diện với góc liên kết
khoảng 109,5o. Do đó, các nguyên tử cacbon trong phân tử ankan (trừ C2H6) không cùng nằm trên một đường thẳng
- Công thức chung: CnH2n+2 (n≥1).
Ví dụ:
@97182@
II. ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP
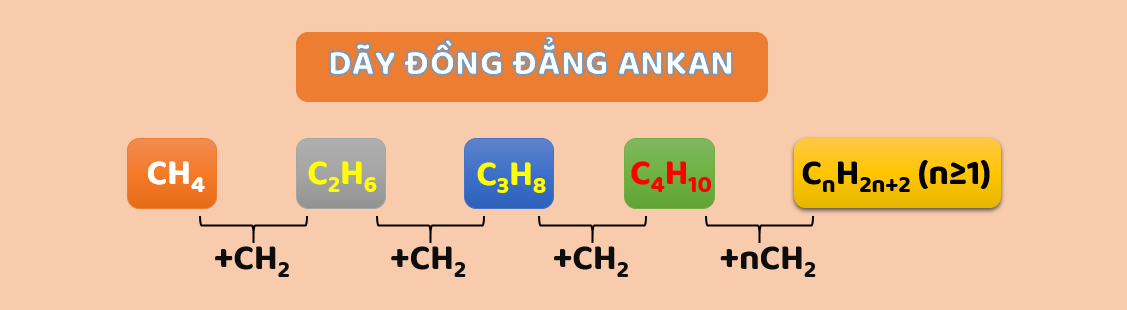
1. Dãy đồng đẳng của ankan
Các ankan gồm metan (CH4) và các chất tiếp theo hơn nhau một hoặc nhiều nhóm -CH2- có công thức phân tử C2H6, C3H8, C4H10, C5H12... lập thành dãy đồng đẳng của ankan và có công thức chung là CnH2n+2 (n≥1).
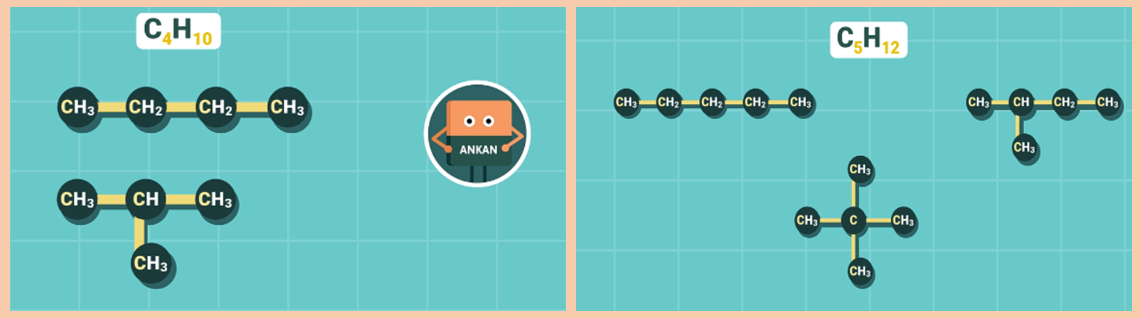
2. Đồng phân
Các ankan có từ 4 nguyên tử cacbon trở lên bắt đầu có đồng phân về mạch cacbon.
Ví dụ:
3. Danh pháp
- Tên thông thường
| Công thức phân tử | CH4 | C2H6 | C3H8 | C4H10 | C5H12 | C6H14 | C7H16 | C8H18 | C9H20 | C10H22 |
| Tên | Metan | Etan | Propan | Butan | Pentan | Hexan | Heptan | Octan | Nonan | Đecan |
| Gốc ankyl | CH3- | C2H5- | C3H7- | C4H9- | C5H11- | C6H13- | C7H15- | C8H17- | C9H19- | C10H21- |
| Tên | Metyl | Etyl | Propyl | Butyl | Pentyl | Hexyl | Heptyl | Octyl | Nonyl | Đecyl |
Tên thay thế (IUPAC)
Các bước gọi tên thay thế của ankan:
Bước 1: Xác định mạch chính.
Chọn mạch cacbon dài nhất và có nhiều nhánh nhất làm mạch chính.
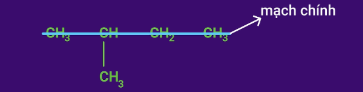
Bước 2: Đánh số.
Đánh số thứ tự các nguyên tử cacbon mạch chính bắt đầu từ phía gần nhánh hơn.
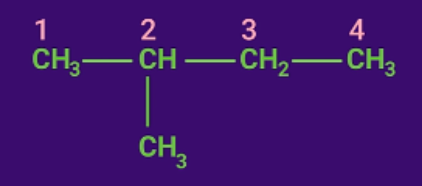
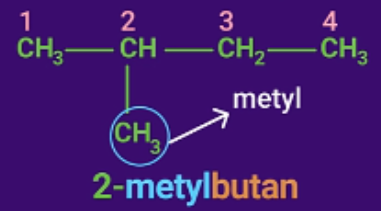
Bước 3: Gọi tên
Tên ankan được gọi theo thứ tự:
![]()
Tên mạch chính: tên mạch cacbon + "an".
Tên mạch nhánh: tên mạch cacbon + "yl".
Bậc của nguyên tử C
Trong phân tử hidrocacbon no, bậc của 1 nguyên tử cacbon được tính bằng số liên kết của nó với các nguyên tử cacbon khác.
Ví dụ:
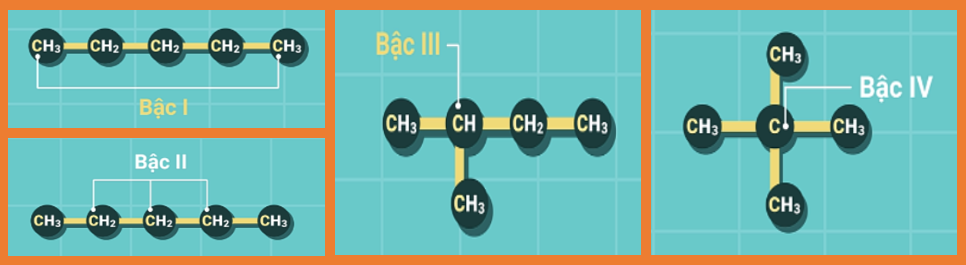
@97482@@97233@@97400@
III. TÍNH CHẤT VẬT LÝ
Ở điều kiện thường:
| Bốn ankan đầu dãy đồng đẳng là những chất khí (CH4 → C4H10) | Các ankan tiếp theo có từ 5 cacbon trở đi là chất lỏng | Đến khoảng C18H38 trở đi là chất rắn. |
|
|
|
Tất cả các ankan đều nhẹ hơn nước và không tan trong nước nhưng tan nhiều trong các dung môi hữu cơ.
Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng của các ankan tăng theo chiều tăng của phân tử khối.
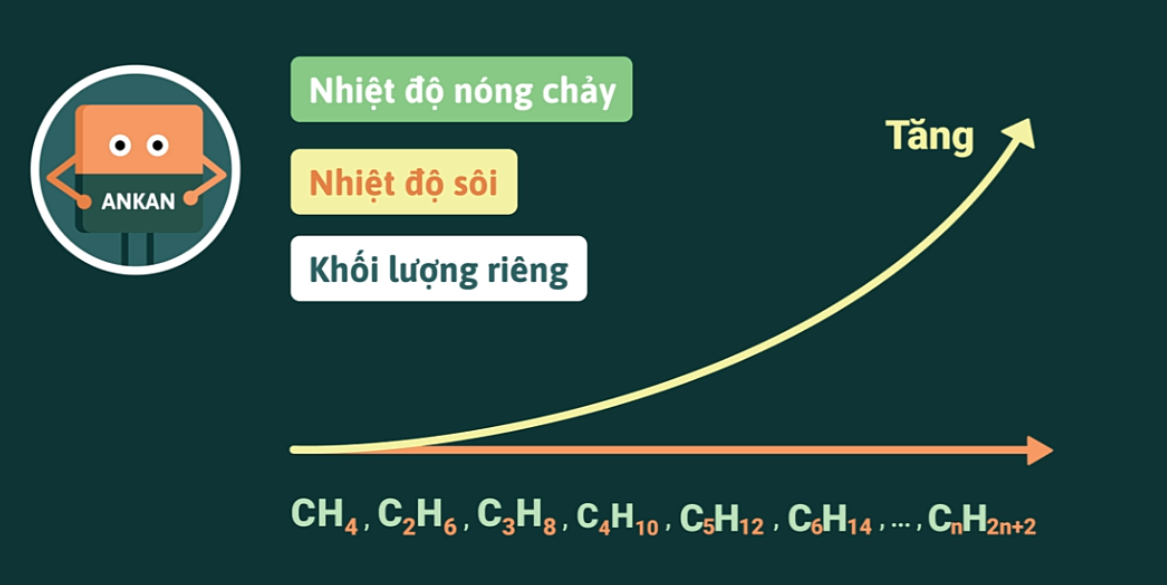
@97552@
III. TÍNH CHẤT HÓA HỌC
Phân tử ankan chỉ chưa các liên kết xích ma σ giữa C-C và C-H bền vững, khó bị cắt đứt, do đó ankan khá trơ về mặt hóa học. Ở nhiệt độ thường, các ankan không tác dụng với dung dịch axit, dung dịch kiềm và các chất oxi hóa mạnh như KMnO4...
Khi chiếu sáng hoặc đun nóng, các ankan dễ dàng tham gia phản ứng thế, phản ứng tách hidro và phản ứng cháy.
Phản ứng đặc trưng của ankan là phản ứng thế.
1. Phản ứng thế bởi halogen
Khi có mặt ánh sáng, các nguyên tử hidro trong phân tử ankan có thể bị thay thế lần lượt bởi các nguyên tử halogen. Tuy nhiên flo phản ứng mãnh liệt nên phân hủy ankan thành C và HF, iot quá yếu nên không phản ứng với ankan, chỉ có clo và brom tham gia phản ứng thế với ankan.
Ví dụ 1: Clo thay thế lần lượt từng nguyên tử H trong phân tử metan.
| CH4 + Cl2 | CH2Cl2 + Cl2 |
| CH3Cl + Cl2 | CHCl3 + Cl2 |
Ví dụ 2: Phản ứng thế của propan với clo.
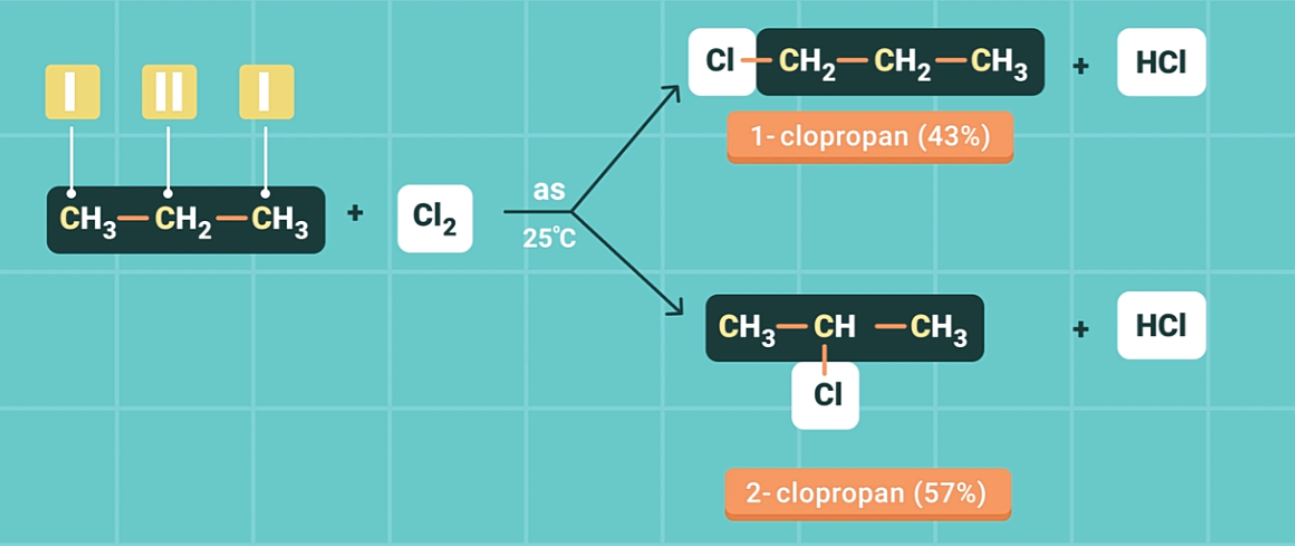
Nhận xét: Nguyên tử H liên kết với C bậc cao hơn trong phân tử ankan dễ bị thế bởi halogen hơn so với nguyên tử H liên kết với C bậc thấp hơn.
Những phản ứng trên gọi là phản ứng halogen hóa, các sản phẩm thế thu được gọi là dẫn xuất halogen của hidrocacbon.
2. Phản ứng tách
Ankan có phân tử khối nhỏ có thể tách hidro để trở thành các hidrocacbon không no tương ứng dưới tác dụng của nhiệt độ và chất xúc tác thích hợp.
CH3-CH3 CH2=CH2 + H2
Ngoài ra, cũng ở nhiệt độ cao và xúc tác thích hợp ngoài việc tách hidro, ankan có thể bị phân cách mạch cacbon tạo thành các phân tử nhỏ hơn (phản ứng cracking).
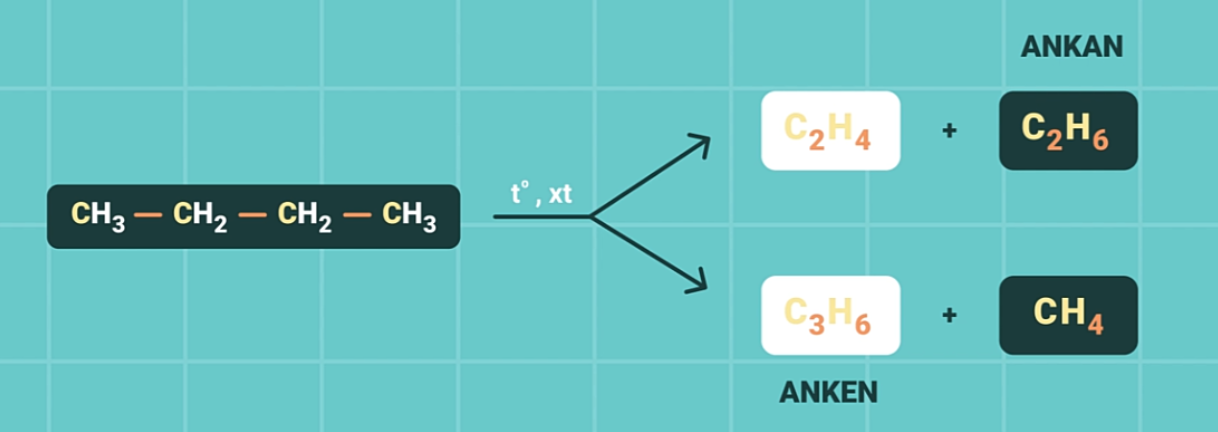
3. Phản ứng oxi hóa
Khi cháy, các ankan đều tỏa nhiều nhiệt. Nhờ đặc tính này, các ankan thường được dùng làm nhiên liệu cho động cơ, máy móc.
CnH2n+2 + O2
nCO2 + (n+1)H2O
@97306@@97627@
IV. ĐIỀU CHẾ
1. Trong phòng thí nghiệm
Metan được điều chế bằng cách đun nóng natri axetat khan với hỗn hợp vôi tôi xút.
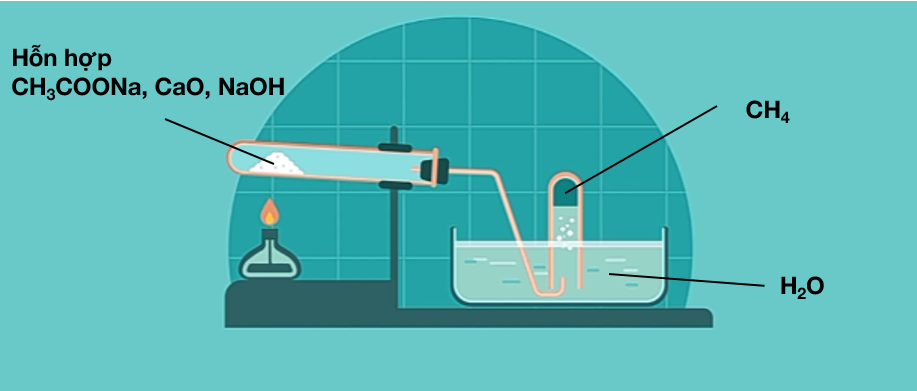
Tổng quát: RCOONa + NaOH R-H + Na2CO3
2. Trong công nghiệp
Các ankan là thành phần chính của dầu mỏ, khí thiên nhiên, khí mỏ dầu.
Từ dầu mỏ, bằng phương pháp chưng cất phân đoạn, người ta thu được ankan ở các phân đoạn khác nhau.
Từ khí thiên nhiên, khí mỏ dầu cũng thu được các ankan đầu dãy đồng đẳng.
.gif)
V. ỨNG DỤNG
Ankan có ứng dụng trong nhiều lĩnh vực: làm nhiên liệu, nguyên liệu, dung môi trong công nghiệp và đời sống.

Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!
Danh sách các phiên bản khác của bài học này. Xem hướng dẫn
| Nguyễn Trần Thành Đạt đã đóng góp một phiên bản khác cho bài học này (20 tháng 4 2021 lúc 19:09) | 0 lượt thích |