Bài 24. Alkene
Nội dung lý thuyết
I. Khái niệm alkene
Alkene là những hydrocarbon mạch hở, trong phân tử có một liên kết đôi 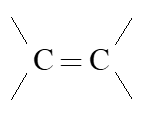 .
.
Công thức chung của các alkene có dạng CnH2n (với n ≥ 2, n là các số nguyên, dương).
@17259509@
II. Ethylene
1. Tính chất vật lí
Ethylene là chất khí ở điều kiện thường (hoá lỏng ở –104 °C và hoá rắn ở –169 °C), không màu, hầu như không tan trong nước, tan ít trong các dung môi hữu cơ như ethylic alcohol.
2. Cấu tạo phân tử
Công thức phân tử của ethylene là C2H4. Công thức cấu tạo của ethylene là  .
.
Phân tử ethylene có liên kết đôi  , trong đó có một liên kết kém bền, dễ bị phá vỡ trong các phản ứng hoá học.
, trong đó có một liên kết kém bền, dễ bị phá vỡ trong các phản ứng hoá học.
3. Tính chất hóa học
a) Phản ứng cháy
Tương tự alkane, phản ứng đốt cháy các alkene tạo ra sản phẩm chủ yếu là khí carbon dioxide và hơi nước. Phản ứng toả ra nhiều nhiệt.
\(\mathrm{C}_2\mathrm{H}_4 + 3 \mathrm{O}_2 \xrightarrow{\text{t°}} 2 \mathrm{CO}_2 + 2 \mathrm{H}_2\mathrm{O}\)
b) Phản ứng cộng
Trong phản ứng của ethylene với nước bromine, phân tử bromine đã cộng hợp vào nối đôi  trong phân tử ethylene, liên kết kém bền trong liên kết đôi bị phá vỡ, tạo thành sản phẩm 1,2-dibromoethane theo phản ứng sau:
trong phân tử ethylene, liên kết kém bền trong liên kết đôi bị phá vỡ, tạo thành sản phẩm 1,2-dibromoethane theo phản ứng sau:

Viết gọn lại là:
\(\mathrm{C}_2\mathrm{H}_4 + \mathrm{Br}_2 \longrightarrow \mathrm{C}_2\mathrm{H}_4\mathrm{Br}_2\)
Phản ứng trên gọi là phản ứng cộng.
c) Phản ứng trùng hợp
Ở điều kiện thích hợp, các phân tử ethylene cộng hợp liên tiếp với nhau, liên kết kém bền trong liên kết đôi của phân tử ethylene bị phá vỡ, tạo thành chất có khối lượng phân tử lớn, theo phương trình hoá học sau:

Phản ứng trên gọi là phản ứng trùng hợp.
Phản ứng trùng hợp ethylene có thể viết như sau:
\(\underset{\text{ethylene}}{n \, \mathrm{CH}_2{=}\mathrm{CH}_2} \xrightarrow{\text{t°, p, xúc tác}} \underset{\text{polyethylene}}{\left( {-}\mathrm{CH}_2{-}\mathrm{CH}_2{-} \right)_n}\)
4. Ứng dụng
Ethylene là nguyên liệu quan trọng cho ngành công nghiệp sản xuất hoá chất và tổng hợp polymer:
- Tổng hợp acetic acid
- Tổng hợp ethylic alcohol
- Sản xuất dung môi
- Kích thích quả mau chín
- Sản xuất polyethylene (PE) và poly(vinyl chloride) (PVC)
@17262329@