Đây là phiên bản do Thảo Phương
đóng góp và sửa đổi vào 28 tháng 6 2021 lúc 22:32. Xem phiên bản hiện hành
Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại
Nội dung lý thuyết
Các phiên bản khác
0
1 gp
I – TÍNH CHẤT VẬT LÍ
1. Tính chất chung: Ở điều kiện thường, các kim loại đều ở trạng thái rắn (trừ Hg), có tính dẻo, dẫn điện, dẫn nhiệt và có ánh kim.
2. Giải thích
a) Tính dẻo
Kim loại có tính dẻo là vì các ion dương trong mạng tinh thể kim loại có thể trượt lên nhau dễ dàng mà không tách rời nhau nhờ những electron tự do chuyển động dính kết chúng với nhau.
b) Tính dẫn điện
- Khi đặt một hiệu điện thế vào hai đầu dây kim loại, những electron chuyển động tự do trong kim loại sẽ chuyển động thành dòng có hướng từ cực âm đến cực dương, tạo thành dòng điện.
- Ở nhiệt độ càng cao thì tính dẫn điện của kim loại càng giảm do ở nhiệt độ cao, các ion dương dao động mạnh cản trở dòng electron chuyển động.
c) Tính dẫn nhiệt
- Các electron trong vùng nhiệt độ cao có động năng lớn, chuyển động hỗn loạn và nhanh chóng sang vùng có nhiệt độ thấp hơn, truyền năng lượng cho các ion dương ở vùng này nên nhiệt độ lan truyền được từ vùng này đến vùng khác trong khối kim loại.
- Thường các kim loại dẫn điện tốt cũng dẫn nhiệt tốt.
d) Ánh kim
Các electron tự do trong tinh thể kim loại phản xạ hầu hết những tia sáng nhìn thấy được, do đó kim loại có vẻ sáng lấp lánh gọi là ánh kim.
* Kết luận: Tính chất vật lí chung của
kim loại gây nên bởi sự có mặt của các electron tự do trong mạng tinh thể kim loại.
* Ngoài một số tính chất vật lí chung của các kim loại, kim loại còn có một số tính chất vật lí không giống nhau.
- Khối lượng riêng: Nhỏ nhất: Li (0,5g/cm3); lớn nhất Os (22,6g/cm3).
- Nhiệt độ nóng chảy: Thấp nhất: Hg (−390C); cao nhất W (34100C).
- Tính cứng: Kim loại mềm nhất là K, Rb, Cs (dùng dao cắt được) và cứng nhất là Cr (có thể cắt được kính).
II. Tính chất hóa học
Tính chất hóa học chung của kim loại là tính khử.
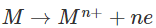
1. Tác dụng với phi kim
Nhiều kim loại có thể khử được phi kim đến số oxi hoá âm, đồng thời nguyên tử kim loại bị oxi hoá đến số oxi hoá dương.
- Tác dụng với clo
Hầu hết các kim loại đều có thể khử trực tiếp clo tạo ra muối clorua.
- Tác dụng với oxi
Hầu hết các kim loại có thể khử oxi từ số oxi hóa 0
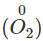
xuống số oxi hóa
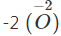
.
- Tác dụng với lưu huỳnh
Nhiều kim loại có thể khử lưu huỳnh từ số oxi hóa 0
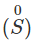
xuống số oxi hóa
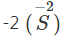
. Phản ứng cần đun nóng (trừ Hg).
2. Tác dụng với dung dịch axit
- Với dung dịch HCl, H2SO4 loãng
Nhiều kim loại có thể khử được ion H+ trong dung dịch HCl, H2SO4 loãng thành hiđro.
- Với dung dịch HN03, H2S04 đặc
Hầu hết kim loại (trừ Pt, Au) khử được N+5 (trong HNO3) và S+6 (trong H2S04) xuống số oxi hóa thấp hơn.
3. Tác dụng với nuớc
Các kim loại ở nhóm IA và IIA của bảng tuần hoàn (trừ Be, Mg) có tính khử mạnh, có thể khử được H2O ở nhiệt độ thường thành hiđro. Các kim loại còn lại có tính khử yếu hơn nên chỉ khử được H2O ở nhiệt độ cao như Fe, Zn,... hoặc không khử được H2O như Ag, Au,...
4. Tác dụng với dung dịch muối
Kim loại mạnh hơn có thể khử được ion của kim loại yếu hơn trong dung dịch muối thành kim loại tự do.
III. Dãy điện hóa của kim loại
1. Cặp oxi hóa - khử của kim loại
Nguyên tử kim loại dễ nhường electron để trở thành ion kim loại, ngược lại ion kim loại có thể nhận electron để trở thành nguyên tử kim loại.
Dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hóa - khử của kim loại.
2. So sánh tính chất của các cặp oxi hóa - khử
Thí dụ: So sánh tính chất của hai cặp oxi hóa - khử Cu2+/Cu và Ag+/Ag.
Thực nghiệm cho thấy Cu tác dụng được với dung dịch muối AgNO3 theo phương trình ion rút gọn:
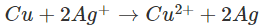
Trong khi đó, ion Cu2+ không oxi hóa được Ag. Như vậy, ion Cu2+ có tính oxi hóa yếu hơn ion Ag+ và kim loại Cu có tính khử mạnh hơn kim loại Ag.
3. Dãy điện hóa của kim loại
Người ta đã so sánh tính chất của nhiều cặp oxi hóa - khử và sắp xếp thành dãy điện hóa của kim loại:

4. Ý nghĩa của dãy điện hóa của kim loại
Dãy điện hóa của kim loại cho phép dự đoán chiều của phản ứng giữa 2 cặp oxi hóa - khử theo quy tắc α: Phản ứng giữa 2 cặp oxi hóa - khử sẽ xảy ra theo chiều chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn, sinh ra chất oxi hóa yếu hơn và chất khử yếu hơn
* Luyện tập
Câu 1: Kết luận nào sau đây là sai ?
A Kim loại có nhiệt độ nóng chảy thấp nhất là Hg.
B Kim loại dẻo nhất là natri.
C. Kim loại dẫn điện tốt nhất là bạc
D Kim loại nhẹ nhất là liti.
Câu 2: Phát biểu nào sau đây không đúng ?
A. Kim loại cesi được dùng để làm tế bào quang điện
B. Kim loại crom được dùng để làm dao cát kính.
C. Kim loai bạc dược dùng để làm dây dẫn điện trong gia đình
D. Kim loại chì được dùng để chế tạo điện cực trong acquy.
Câu 3: Cho các kim loại sau : Li, Mg, Al, Zn, Fe, Ni. Có bao nhiêu kim loại tác dụng với HCl và Cl2 thu được cùng một muối ?
A. 6 B. 3 C. 4 D. 5
Câu 4: Một học sinh tiến hành thí nghiệm : Nhúng một thanh đồng vào dung dịch AgNO3, sau một lúc nhúng tiếp một thanh sắt vào dung dịch này đến phản ứng hoàn toàn. Sau khi thí nghiệm kết thúc, học sinh đó rút ra các kết luận sau :
(I) Dung dịch thu được sau phản ứng có màu xanh nhạt.
(II) Khối lượng thanh đồng bị giảm sau phản ứng.
(III) Khối lượng thanh sắt tăng lên sau phản ứng.
Kết luận không đúng là
A. (I). B. (II). C. (III). D. (I) (II) và (III)
Câu 5: Hoà tan hoàn toàn a gam hỗn hờp gồm FeO và Fe2O3 (tỉ lệ mol 1:1) vào dung dịch HCl. Thêm tiếp b gam Cu vào dung dịch thu được ở trên thấy Cu tan hoàn toàn. Mối quan hệ giữa a và b là
A. 64a >232b. B. 64a < 232b. C. 64a > 116b. D. 64a < 116b.
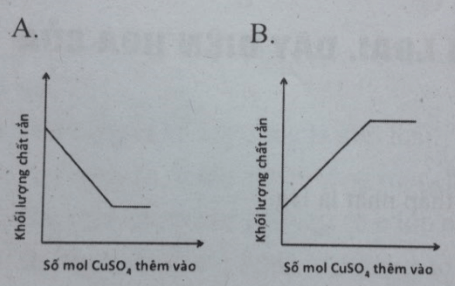
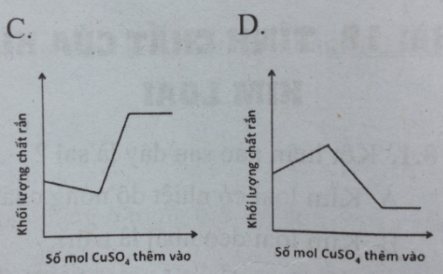
Câu 6: Thêm từ từ dung dịch H2SO4 đến dư vào cốc đựng hỗn hợp bột Zn và Fe, phản ứng là hoàn toàn. Mối quan hệ giữa số mol CuSO4 thêm vào và khối lượng chất rắn sau phản ứng có thể biểu diễn bằng đồ thị nào dưới đây ?
![]()
![]()
Câu 7: Cho m gam hỗn hợp bột Fe và Cu vào dung dịch AgNO3 dư. Khuấy kĩ cho đến khi phản ứng hoàn toàn thu được 35,64 gam kim loại. Mặt khác cũng cho m gam hỗn hợp trộn vào dung dịch CuSO4 dư, khuấy kĩ cho đến khi phản ứng kết thúc, thu được m + 0,72 gam kim loại. Giá trị của m là
A. 9,84. B. 8,34. C. 5,79. D. 6,96
Câu 8: Cho 2,8 gam bột sắt và 0,81 gam bột nhôm vào 100 ml dung dịch A chứa Cu(NO3)2 và AgNO3. Khuấy kĩ đến khi phản ứng hoàn toàn, thu được chất rắn B gồm 3 kim loại có khối lượng 8,12 gam. Cho B tác dụng với dung dịch HCl dư thu được 0,672 lít H2 (đktc). Nồng độ mol của Cu(NO3)2 là
A.0.3M. B.0,5M. C. 0,6M. D, 1M.
Câu 9: Có các phản ứng như sau :
1. Fe + 2H+ → Fe2+ + H2
2. Fe + Cl2 → FeCl2
3. AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag
4. Ca + FeCl2 dung dịch → CaCl2 + Fe
5. Zn + 2FeCl3 → ZnCl2 + 2FeCl2
6. 3Fe dư + 8HNO3 loãng →3Fe(NO3)2 + 2NO + 4H2O
Trong các phản ứng trên, số phản ứng viết không đúng là
A. 1 B. 2. C. 3. D. 4.
Câu 10: Cho các phát biểu sau :
1. Có thể dùng lưu huỳnh để khử độc thủy ngân.
2. Có thể dùng thùng bằng kẽm để vận chuyển HNO3 dặc, nguội.
3. Ngay cả ở nhiệt độ cao, magie không tác dụng với nước.
4. Bạc để lâu trong không khí có thể bị hoá đen do chuyển thành Ag2S.
Trong các phát biểu trên, số phát biếu đứng là
A. 1. B. 2. C. 3. D. 4.
Câu 11: Cho sơ đồ phản ứng của kim loại M với HNO3 như sau :
M + HNO3 → M(NO3)n + NxOy + H2O
Sau khí cân bằng PTHH, hệ số tối giản của HNO3 là
A. (3x - 2y)n. B. (3x - y)n. C. (2x - 5y)n. D.(6x - 2y)n.
Câu 12: Các hỗn hợp chất nào sau đây không cùng tồn tại trong cùng một dung dịch ?
A. Ni(NO3)2 và AgNO3 B. Fe(NO3)2 và AgNO3
C. Fe(NO3)2 và Cu(NO3)2 D. Hg(NO3)2 và Cu(NO3)2
Câu 13: Cho các phản ứng sau :
a) Cu2+ + Fe → Cu + Fe2+
b) Cu + 2Fe3+ → Cu2+ + 2Fe2+
c) Fe2+ + Mg → Fe + Mg2+
Nhận xét nào dưới đây là đúng ?
A. Tính khử : Mg > Fe > Fe2+ > Cu.
B. Tính khử: Mg > Fe2+ > Cu > Fe.
C. Tính oxi hoá: Cu2+ >Fe3+ > Fe2+ > Mg2+
D. Tính oxi hoá : Fe3+ > Cu2+ > Fe2+> Mg2+
Câu 14: Cho 7,22 gam hỗn hợp X gồm sắt và một kim loại M có hoá trị không đổi.
Chia X thành 2 phần bằng nhau:
Phần (1) : tác dụng với dung dịch HCl dư tạo ra 2,128 lít khí (đktc)
Phần (2) : tác dụng với dung dịch HNO3 dư tạo ra 1,792 lít (đktc) NO (sản phẩm khử duy nhất của N+5).
Phần trăm khối lượng của M trong X là
A 22,44%. B. 55,33%. C. 24,47%. D.11,17%.
Câu 15: Cho 10 gam hỗn hợp X gồm Zn, Fe và Mg vào duns dịch HCl dư thu đưov dung dịch Y. Thêm tiếp KNO3 dư vào dung dịch Y thì thu được 0,672 lit khi NO duy nhất (đktc). Phần trăm khối lượng sắt có trong hỗn hợp X là
A. 5,6%. B. 16,8%. C. 50,4%. D. 33,6%.
Câu 16. Trong bảng hệ thống tuần hoàn, phân nhóm chính của phân nhóm nào sau đây chỉ gồm toàn kim loại:
A. Nhóm I ( trừ hidro ), II và III B. Nhóm I ( trừ hidro )
C. Nhóm I ( trừ hidro ) Và II D. Nhóm I ( trừ hidro ), II, III và IV.
Câu 17. Cho Na (Z=11). Cấu hình electron của nguyên tử Na là:
A. 1s22s22p63s33p5. B. 1s22s22p63s1. C. 1s22s32p6. D. 1s22s22p53s3
Câu 18. Fe có Z =26. Cấu hình electron của ion Fe2+ là:
A. 1s22s22p63s23p63d44s2. B. 1s22s22p63s23p63d6. C. 1s22s22p63s23p63d54s1. D. Kết quả khác.
Câu 19. Cho cấu hình electron: 1s22s22p63s23p6. Dãy gồm các nguyên tử và ion có cấu hình electron trên là:
A. Ca2+, Cl, Ar. B. Ca2+, F, Ar. C. K+, Cl, Ar. D. K+, Cl-, Ar.
Câu 20. Kim loại có các tính chất vật lý chung là:
A. Tính dẻo, tính dẫn điện, tính dẫn nhiệt, ánh kim.
B. Tính dẫn điện, tính dẫn nhiệt, ánh kim, tính đàn hồi.
C. Tính dẻo, tính dẫn điện, tính khó nóng chảy, ánh kim.
D. Tính dẻo, tính dẫn điện, tính dẫn nhiệt, tính cứng.
Câu 21. Trong các phát biểu sau, phát biểu đúng là:
A. Bản chất của liên kết kim loại là lực hút tĩnh điện.
B. Một chất oxi hoá gặp một chất khử nhất thiết phải xảy ra phản ứng hoá học.
C. Với một kim loại, chỉ có thể có một cặp oxi hoá – khử tương ứng.
D. Đã là kim loại phải có nhiệt độ nóng chảy cao.
Câu 22. Liên kết kim loại là
A. liên kết sinh ra bởi lực hút tĩnh điện giữa các ion dương và các electron tự do.
B. liên kết sinh ra bởi lực hút tĩnh điện giữa ion dương và các ion âm.
C. liên kết giữa các nguyên tử bằng các cặp electron dùng chung.
D. liên kết sinh ra bởi lực hút tĩnh điện giữa nguyên tử H tích điện dương và nguyên tử O tích điện âm.
Câu 23. Trong mạng tinh thể kim loại có
A. các nguyên tử kim loại. B. các electron tự do.
C. các ion dương kim loại và các electron tự do. D. ion âm phi kim và ion dương kim loại.
* Tìm hiểu mở rộng
Vàng và sự trao đổi tiền tệ
Vàng đã được sử dụng rộng rãi trên khắp thế giới như một phương tiện chuyển đổi tiền tệ, hoặc bằng cách phát hành và công nhận các đồng xu vàng hay các số lượng kim loại khác, hay thông qua các công cụ tiền giấy có thể quy đổi thành vàng bằng cách lập ra bản vị vàng theo đó tổng giá trị tiền được phát hành được đại diện bởi một lượng vàng dự trữ.
Tuy nhiên, số lượng vàng trên thế giới là hữu hạn và việc sản xuất không gia tăng so với nền kinh tế thế giới. Ngày nay, sản lượng khai thác vàng đang sụt giảm. Với sự tăng trưởng mạnh của các nền kinh tế trong thế kỷ 20, và sự gia tăng trao đổi quốc tế, dự trữ vàng thế giới và thị trường của nó đã trở thành một nhánh nhỏ của toàn bộ các thị trường và các tỷ lệ trao đổi tiền tệ cố định với vàng đã trở nên không thể duy trì. Ở đầu Thế chiến I các quốc gia tham gia chiến tranh đã chuyển sang một bản vị vàng nhỏ, gây lạm phát cho đồng tiền tệ của mình để có tiền phục vụ chiến tranh. Sau Thế chiến II vàng bị thay thế bởi một hệ thống tiền tệ có thể chuyển đổi theo hệ thống Bretton Woods. Bản vị vàng và tính chuyển đổi trực tiếp của các đồng tiền sang vàng đã bị các chính phủ trên thế giới huỷ bỏ, bị thay thế bằng tiền giấy. Thuỵ Sĩ là quốc gia cuối cùng gắn đồng tiền của mình với vàng; vàng hỗ trợ 40% giá trị của tiền cho tới khi Thuỵ Sĩ gia nhập Quỹ Tiền tệ Quốc tế năm 1999.
Vàng nguyên chất quá mềm để có thể được sử dụng như tiền tệ hàng ngày và nó thường được làm cứng thêm bằng cách thêm đồng, bạc hay các loại kim loại cơ sở khác. Hàm lượng vàng trong hợp kim được xác định bằng cara (k). Vàng nguyên chất được định danh là 24k. Các đồng xu vàng được đưa vào lưu thông từ năm 1526 tới thập niên 1930 đều là hợp chất vàng tiêu chuẩn 22k được gọi là vàng hoàng gia, vì độ cứng.
Danh sách các phiên bản khác của bài học này. Xem hướng dẫn