Đây là phiên bản do Song Ngư
đóng góp và sửa đổi vào 30 tháng 8 2021 lúc 20:19. Xem phiên bản hiện hành
Bài 1. Tính chất hóa học của oxit. Khái quát về sự phân loại oxit
Nội dung lý thuyết
Các phiên bản khác
2
2 gp
Tính chất hóa học của Oxit. Khái quát về sự phân loại Oxit
I. Tính chất hóa học của Oxit
1. Oxit Bazơ
a) Oxit Bazơ: K2O, Na2O, Li2O, CaO, BaO + H2O \(\rightarrow\) Dung dịch Bazơ
K2O + H2O \(\rightarrow\) 2KOH
(Phênolphtalêin hay còn viết là Phenolphthalein (theo tiếng Anh), được ứng dụng trong phân tích hóa học với vai trò như một loại thuốc thử để xác định điểm tương đương trong các phản ứng trung hòa hay chuẩn độ axit – bazơ)
b) Oxit Bazơ + Dung dịch Axit \(\rightarrow\) Muối tương ứng + H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
CuO + H2SO4 \(\rightarrow\) CuSO4 + H2O
Ag2O + 2HNO3 \(\rightarrow\) 2AgNO3 + H2O
Fe3O4 + HCl \(\rightarrow\) FeCl2 + FeCl3 + H2O
c) Oxit Bazơ + Oxit Axit \(\rightarrow\) Muối
CaO + CO2 \(\rightarrow\) CaCO3
3K2O + P2O5 \(\rightarrow\) 2K3PO4
Na2O + 2NO2 \(\rightarrow\) 2NaNO3 + NaNO2
BaO + SO2 \(\rightarrow\) BaSO3
d) Một số Oxit Bazơ phản ứng với chất khử
Fe2O3 + 3H2 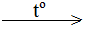 2Fe + 3H2O
2Fe + 3H2O
Fe3O4 + 4CO 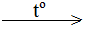 3Fe + 4CO2
3Fe + 4CO2
2CuO + C 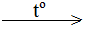 2Cu + CO2
2Cu + CO2
3Fe3O4 + 8Al 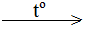 9Fe + 4Al2O3
9Fe + 4Al2O3
2. Oxit Axit
a) Oxit Axit + H2O \(\rightarrow\) Dung dịch Axit
SO2 + H2O \(\rightarrow\) 2H3PO4
P2O5 + 3H2O \(\rightarrow\) 3HNO3
N2O5 + H2O \(\rightarrow\) 2HNO3
SO3 + H2O \(\rightarrow\) H2SO4
b) Oxit Axit + Oxit Bazơ \(\rightarrow\) Muối
SO2 + Na2O \(\rightarrow\) Na2SO3
CO2 + BaO \(\rightarrow\) BaCO3
c) Tác dụng với dung dịch Bazơ
Dạng 1: Oxit Axit (CO2, SO2) + Dung dịch Bazơ của kim loại hóa trị II
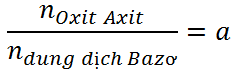
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
CO2 + Ca(OH)2 → Ca(HCO3)2 (2)
CO2 + CaCO3 + H2O → Ca(HCO3)2 (3)
TH1: a \(\le\) 1 à Tạo muối trung hòa (1)
TH2: a \(\ge\) 2 à Tạo muối Axit (2)
TH3: 1 < a < 2 à Tạo 2 muối – Viết phương trình (1) + (2) hoặc (1) + (3)
Dạng 2: Oxit Axit + Dung dịch Bazơ của kim loại hóa trị I
SO2 + 2NaOH \(\rightarrow\) Na2SO3 + H2O (1)
SO2 + NaOH \(\rightarrow\) NaHSO3 (2)
SO2 + Na2SO3 + H2O \(\rightarrow\) NaHSO3 (3)
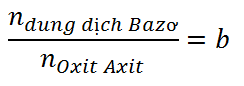
TH1: b ≤ 1 à Tạo muối Axit (1)
TH2: b ≥ 2 à Tạo muối trung hòa (2)
TH3: 1 < b < 2 à Tạo 2 muối – Viết phương trình (1) + (2) hoặc (1) + (3)
d) Có khả năng khử một số các chất
CO2 + Mg \(\rightarrow\) MgO + CO
SO2 + Cl2 + 2H2O \(\rightarrow\) H2SO4 + HCl
vàng không màu
SO2 + Br2 + 2H2O \(\rightarrow\) H2SO4 + 2HBr
da cam không màu
II. Phân loại
1. Oxit Bazơ
- Là Oxit tác dụng được với dung dịch Axit để tạo thành muối và nước.
2. Oxit Axit
- Là Oxit tác dụng được với dung dịch Bazơ để tạo thành muối và nước.
3. Oxit trung tính (NO, CO, N2O,…)
- Là oxit không tác dụng được với dung dịch Bazơ, không tác dụng với dung dịch Axit và H2O.
- Oxit không tạo muối.
4. Oxit lưỡng tính (ZnO, Al2O3, BeO, Cr2O3)
- Là những Oxit vừa tác dụng với dung dịch Oxit Axit, Oxit Bazơ tạo ra muối và nước.
ZnO + 2HCl \(\rightarrow\) ZnCl2 + H2O
ZnO + 2NaOH \(\rightarrow\) Na2ZnO2 + H2O
Natri Zincat
Al2O3 + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2O
Al2O3 + Ba(OH)2 \(\rightarrow\) Ba(AlO2)2 +H2O
Bari Aluminat
P/s: Ở đây mình có bổ sung thêm kiến thức nâng cao nên có gì mong các bạn thông cảm và bỏ qua cho mk!!!
Danh sách các phiên bản khác của bài học này. Xem hướng dẫn