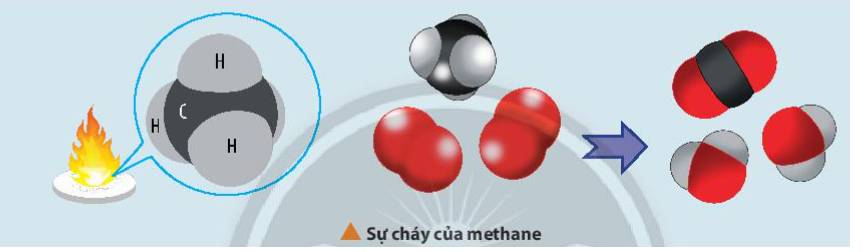
Methane cháy tỏa nhiệt lớn nên được dùng làm nhiên liệu. Khi trộn methane và oxygen với tỉ lệ thích hợp thì sẽ tạo ra hỗn hợp nổ.
Biến thiên enthalpy của phản ứng trên được tính toán dựa trên các giá trị nào?
Methane cháy tỏa nhiệt lớn nên được dùng làm nhiên liệu. Khi trộn methane và oxygen với tỉ lệ thích hợp thì sẽ tạo ra hỗn hợp nổ.

Biến thiên enthalpy của phản ứng trên được tính toán dựa trên các giá trị nào?
Quan sát Hình 14.1 cho biết liên kết hóa học nào bị phá vỡ, liên kết hóa học nào được hình thành khi H2 phản ứng với O2 tạo thành H2O (ở thể khí)?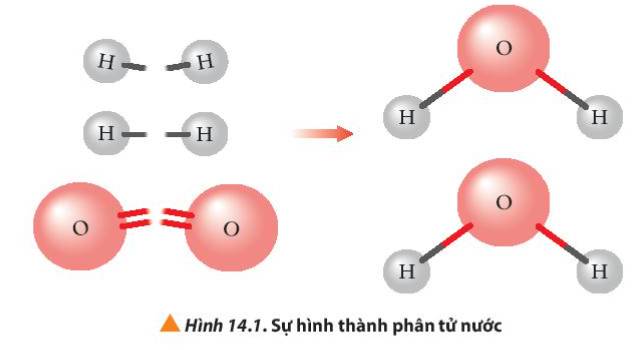
Thảo luận (1)Hướng dẫn giải- Khi H2 phản ứng với O2 tạo thành H2O (ở thể khí)
+ Liên kết H-H và O=O bị phá vỡ
+ Liên kết H-O-H được hình thành
(Trả lời bởi Mai Trung Hải Phong)
Tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết phải viết được công thức cấu tạo của tất cả các chất trong phản ứng để xác định số lượng và loại liên kết. Xác định số lượng mỗi loại liên kết trong các phân tử sau: CH4, CH3Cl, NH3, CO2.
Thảo luận (1)Hướng dẫn giải- CH4:
=> Có 4 liên kết C-H
- CH3Cl:
=> Có 3 liên kết C-H, 1 liên kết C-Cl
- NH3
=> Có 3 liên kết N-H
- CO2
=> Có 2 liên kết C=O
(Trả lời bởi Mai Trung Hải Phong)
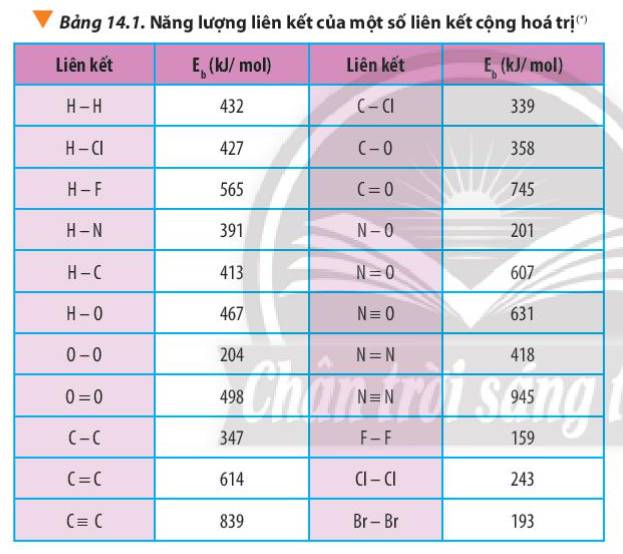
Dựa vào năng lượng liên kết ở Bảng 14.1, tính biến thiên enthalpy của phản ứng và giải thích vì sao nitrogen (N≡N) chỉ phản ứng với oxygen (O=O) ở nhiệt độ cao hoặc có tia lửa điện để tạo thành nitrogen monoxide (N=O).
N2(g) + O2(g) \(\underrightarrow{t^o}\) 2NO(g)
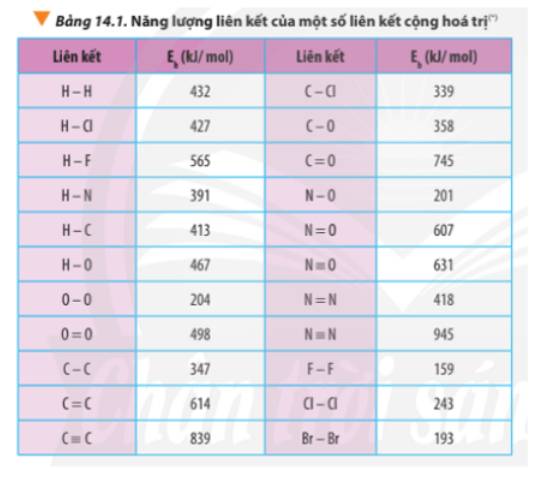
Thảo luận (1)Hướng dẫn giải
Xác định Δr\(H^0_{298}\)của phản ứng sau dựa vào giá trị Eb ở Bảng 14.1:
CH4(g) + Cl2(g) \(\underrightarrow{askt}\) CH3Cl(g) + HCl(g)
Hãy cho biết phản ứng trên tỏa nhiệt hay thu nhiệt?
Thảo luận (1)Hướng dẫn giải
Dựa vào số liệu về năng lượng liên kết ở Bảng 14.1, hãy tính biến thiên enthalpy của 2 phản ứng sau:
2H2(g) + O2(g) \(\underrightarrow{t^o}\) 2H2O(g) (1)
C7H16(g) + 11O2(g) \(\underrightarrow{t^o}\) 7CO2(g) + 8H2O(g) (2)
So sánh kết quả thu được, từ đó cho biết H2 hay C7H16 là nhiên liệu hiệu quả hơn cho tên lửa (biết trong C7H16 có 6 liên kết C-C và 16 liên kết C-H)

Thảo luận (1)Hướng dẫn giải
Tính Δr\(H^0_{298}\)của hai phản ứng sau:
3O2(g) → 2O3(g) (1)
2O3(g) → 3O2(g) (2)
Liên hệ giữa giá trị Δr\(H^0_{298}\)với độ bền của O3, O2 và giải thích, biết phân tử O3 gồm 1 liên kết đôi O=O và 1 liên kết đơn O-O.
Thảo luận (1)Hướng dẫn giải
Tính biến thiên enthalpy của phản ứng phân hủy trinitroglycerin (C3H5O3(NO2)3), theo phương trình sau (biết nhiệt tạo thành của nitroglycerin là -370,15 kJ/mol):
4C3H5O3(NO2)3(s) → 6N2(g) + 12CO2(g) + 10H2O(g) + O2(g)
Hãy giải thích vì sao trinitroglycerin được ứng dụng làm thành phần thuốc súng không khói.
Thảo luận (1)Hướng dẫn giải
Giá trị biến thiên enthalpy của phản ứng có liên quan tới hệ số các chất trong phương trình nhiệt hóa học không? Giá trị enthalpy tạo thành thường được đo ở điều kiện nào?
Thảo luận (1)Hướng dẫn giải- Giá trị biến thiên enthalpy của phản ứng có liên quan tới hệ số các chất trong phương trình nhiệt hóa học.
Khi tính giá trị biến thiên enthalpy của phản ứng thì cần nhân hệ số tỉ lượng với enthalpy tạo thành của các chất tương ứng.
- Giá trị enthalpy tạo thành thường được đo ở điều kiện chuẩn: Áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và thường chọn nhiệt độ 25oC (hay 298K)
(Trả lời bởi GV Nguyễn Trần Thành Đạt)
Dựa vào giá trị enthalpy tạo thành ở Bảng 13.1, hãy tính giá trị Δr\(H^0_{298}\)của các phản ứng sau:
CS2(l) + 3O2(g) \(\underrightarrow{t^o}\) CO2(g) + 2SO2(g) (1)
4NH3(g) + 3O2 \(\underrightarrow{t^o}\) 2N2(g) + 6H2O(g) (2)
Thảo luận (1)Hướng dẫn giải