Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Các câu hỏi tương tự
Biểu diễn cấu hình electron của các nguyên tử có Z = 8 và Z = 11 theo ô orbital.
Silicon được sử dụng trong nhiều ngành công nghiệp: gốm, men sứ, thủy tinh, luyện thép, vật liệu bán dẫn,… Hãy biểu diễn cấu hình electron của nguyên tử silicon (Z = 14) theo ô orbital, chỉ rõ việc áp dụng các nguyên lí vững bền, nguyên lí Pauli và quy tắc Hund.
Quan sát Hình 3.3 và nêu sự định hướng của các AO p trong không gian.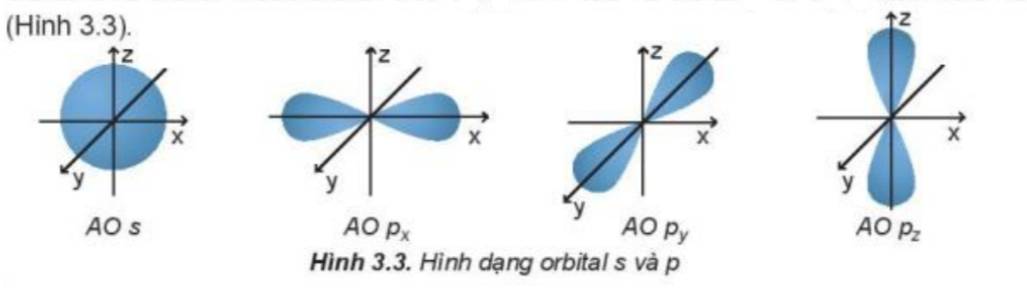
Lớp electron có số electron tối đa gọi là lớp electron bão hòa. Tổng số electron tối đa có trong các lớp L và M là
A. 2 và 8
B. 8 và 10
C. 8 và 18
D. 18 và 32
Hãy cho biết tổng số electron tối đa chứa trong
a) Phân lớp p
b) Phân lớp d
Viết được cấu hình electron nguyên tử của một số nguyên tố hóa học quen thuộc trong thực tế như: nitrogen, oxygen, aluminium… và dự đoán được tính chất hóa học cơ bản của chúng.
Chlorine (Z = 17) thường được sử dụng để khử trùng nước máy trong sinh hoạt. Viết cấu hình electron của nguyên tử chlorine và cho biết tại sao chlorine là phi kim.
Trong nguyên tử các electron chuyển động như thế nào? Sự sắp xếp các electron ở các lớp, các phân lớp tuân theo nguyên lí và quy tắc nào?
Mô hình hiện đại mô tả sự chuyển động của electron trong nguyên tử như thế nào?




