Chủ đề 5: Một số quy luật biến đổi trong bảng tuần hoàn
Nội dung lý thuyết
Các phiên bản khácMỘT SỐ QUY LUẬT BIẾN ĐỔI TRONG BẢNG TUẦN HOÀN
1. Sự biến đổi cấu hình electron.
- Cấu hình electron lớp ngoài cùng của các nhóm được lặp lại sau mỗi chu kì
Ví dụ: Na và K đều thuộc nhóm IA. Cấu hình electron của Na là [Ne] 3s1, cấu hình electron của K là [Ar] 4s1.
2. Sự biến đổi tính kim loại, tính phi kim
- Trong một chu kì, theo chiều tăng của điện tích hạt nhân: tính kim loại giảm; tính phi kim tăng.
Ví dụ: - Na và Mg là 2 kim loại cùng thuộc chu kì 2, nhóm IA và IIA. So sánh tính kim loại Na > Mg.
- Trong một nhóm A, theo chiều tăng của điện tích hạt nhân: tính kim loại tăng; tính phi kim giảm.
Ví dụ: -Nhóm VIIA gồm các nguyên tố 9F, 17Cl, 35Br, 53I. So sánh tính phi kim của các nguyên tố F, Cl, Br, I: F> Cl > Br > I.
3. Sự biến đổi bán kính
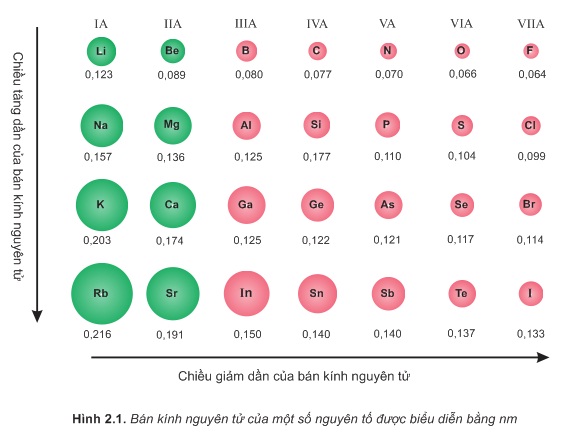
4. Sự biến đổi độ âm điện
- Độ âm điện là đại lượng đặc trưng cho khả năng hút electron của nguyên tử khi hình thành liên kết hóa học.
- Phi kim có xu hướng nhận thêm electron để đạt được cấu hình của khí hiếm. Còn kim loại thì nhường electron để đạt được cấu hình của khí hiếm. Vì vậy tính phi kim càng mạnh thì độ âm điện càng lớn và ngược lại tính kim loại mạnh thì độ âm điện nhỏ. Trong bảng tuần hoàn: flo (F) là nguyên tố có độ âm điện lớn nhất » 4 (theo thang đo của Pauling).

5. Hóa trị của các nguyên tố
- Trong cùng một chu kì, đối với các nguyên tố nhóm A thì hóa trị biến đổi tăng dần từ I đến VII. Hóa trị cao nhất của nguyên tố chính là số thứ tự của nhóm (ngoại trừ flo và oxi).
- Oxit có hóa trị cao nhất có công thức là R2On; hợp chất với hiđro có công thức là RH8-n (n là hóa trị cao nhất của nguyên tố).
Nhóm | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
Nguyên tố | Na | Mg | Al | Si | P | S | Cl |
Hóa trị | I | II | III | IV | V | VI | VII |
Oxit hóa trị cao nhất | Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 |
Hợp chất với hiđro |
|
|
| SiH4 | PH3 | H2S | HCl |
6. Sự biến đổi tính axit-bazo
Nhóm | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
Oxit | Na2O Oxit bazo | MgO Oxit bazo | Al2O3 Oxit lưỡng tính | SiO2 Oxit axit | P2O5 Oxit axit | SO3 Oxit axit | Cl2O7 Oxit axit
|
Hiđroxit | NaOH Bazo mạnh | Mg(OH)2 Bazo yếu | Al(OH)3 Hiđroxit Lưỡng tính | H2SiO3 Axit yếu | H3PO4 Axit trung bình | H2SO4 Axit mạnh | HClO4 Axit mạnh |