Bài 32: Ankin
Nội dung lý thuyết
Các phiên bản khácI. GIỚI THIỆU VỀ ANKIN
- Định nghĩa: Là hidrocacbon không no, mạch hở, có một liên kết CΞC trong phân tử.
- Công thức phân tử: CnH2n-2 (n≥2).

@128631@@128686@
II. ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP
1. Dãy đồng đẳng ankin
Axetilen và các chất tiếp theo hơn kém nhau 1 hay nhiều nhóm CH2 có công thức C3H4, C4H6... có tính chất tương tự axetilen lập thành dãy đồng đẳng của ankin và có công thức phân tử chung là CnH2n-2 (n≥2).
.png)
2. Đồng phân
- Hai chất đầu dãy C2H2 và C3H4 không có đồng phân ankin.
- Các ankin từ C4H6 trở đi có đồng phân về vị trí liên kết ba.

- Từ C5H8 có đồng phân về mạch cacbon tương tự anken.

3. Danh pháp
- Tên thông thường
Các ankin có tên thông thường xuất phát từ ankin đơn giản nhất là axetilen và được gọi theo quy tắc sau:
| Tên gốc ankyl liên kết với nguyên tử C của liên kết ba + "axetilen" |
Các gốc ankyl được gọi theo thứ tự chữ cái đầu tên gọi của chúng trong bảng chữ cái.
Ví dụ:


- Tên thay thế
Tên thay thế của ankin được xuất phát từ ankan tương ứng có cùng mạch cacbon sau khi đổi đuôi "an" thành "in". Từ C4H6 trở đi có đồng phân về vị trí liên kết ba nên cần thêm số chỉ vị trí nguyên tử cacbon bắt đầu liên kết ba. Mạch cacbon được đánh số từ phía gần liên kết ba hơn.


Các ankin có liên kết ba ở đầu mạch dạng R-CΞCH được gọi là các ank-1-in.
@129170@@129110@
II. TÍNH CHẤT VẬT LÝ
- Các ankin có nhiệt độ sôi tăng dần theo chiều tăng của phân tử khối. Các ankin có nhiệt độ sôi cao hơn và khối lượng riêng lớn hơn các anken tương ứng.

- Giống với ankan và anken, các ankin cũng không tan trong nước và nhẹ hơn nước.
.png)
@128748@
III. TÍNH CHẤT HÓA HỌC
Liên kết ba trong phân tử ankin gồm 2 liên kết π kém bền và 1 liên kết σ bền, do đó, giống với anken các ankin dễ dàng tham gia phản ứng cộng. Ngoài ra các ank-1-in còn có thể tham gia phản ứng thế nguyên tử H liên kết với nguyên tử C của liên kết ba bằng nguyên tử kim loại.

1. Phản ứng cộng
Do có 2 liên kết π nên ankin có thể tham gia cộng một hoặc hai phân tử tác nhân để bẻ gãy một hoặc hai liên kết π tạo thành hợp chất không no loại anken hoặc hợp chất no.
a) Cộng hidro
Khi có niken (hoặc platin hoặc paladi) làm xúc tác, ankin cộng hidro tạo thành anken, sau đó phản anken vừa sinh ra tiếp tục phản ứng với hidro để tạo thành ankan.
Ví dụ:
CHΞCH + H2 CH2=CH2
CH2=CH2 + H2 CH3-CH3
Để khống chế phản ứng chỉ xảy ra ở giai đoạn tạo anken, ta dùng xúc tác là hỗn hợp Pd/PbCO3 hoặc Pd/BaSO4.
CHΞCH + H2 CH2=CH2
Đặc tính này dùng để điều chế anken từ ankin.
b) Cộng brom, clo
Brom và clo cũng tác dụng với ankin theo hai giai đoạn liên tiếp.
Ví dụ:

.png)
c) Cộng HX (X là OH, Cl, Br, CH3COO...)
Các ankin tác dụng với HX theo hai giai đoạn liên tiếp.
Ví dụ:
.png)
.png)
Phản ứng cộng HX của các ankin cũng tuân theo quy tắc Mac-côp-nhi-côp.
Khi có xúc tác thích hợp, ankin tác dụng với HCl sinh ra dẫn xuất monoclo của anken.
CHΞCH + HCl CH2=CHCl
Tuy nhiên, phản ứng cộng nước của ankin chỉ xảy ra theo tỉ lệ mol 1:1
Ví dụ: Phản ứng của axetilen với nước.

Lưu ý: Các hợp chất hữu cơ có nhóm -OH liên kết trực tiếp với nguyên tử cacbon không no kém bền, tự chuyển hóa thành hợp chất khác bền hơn.

CHΞCH + H2O CH3CHO
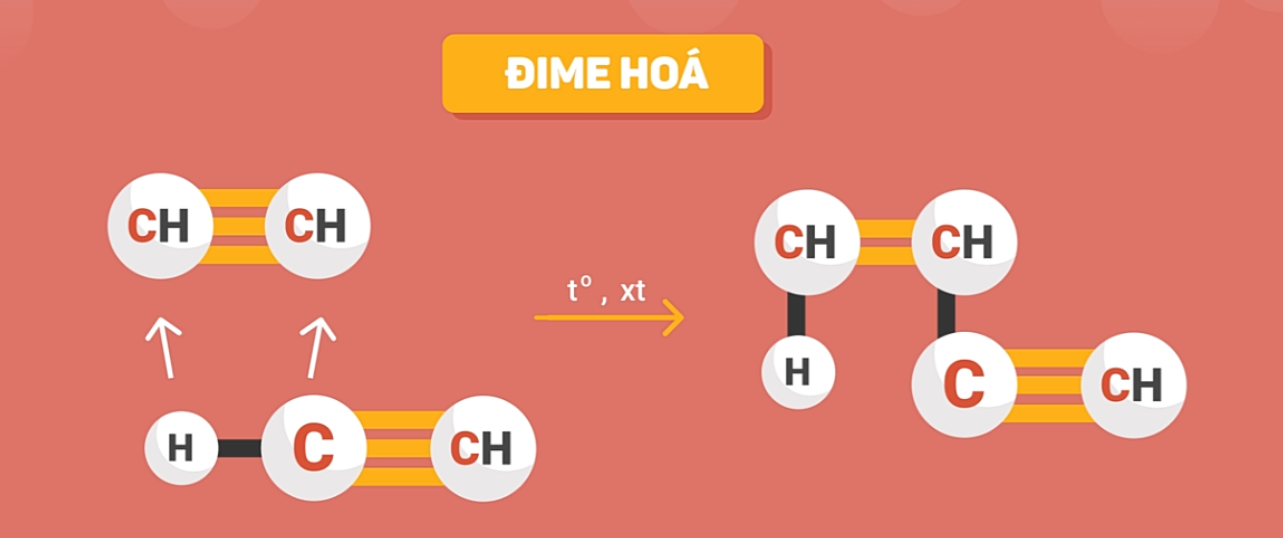
d) Phản ứng đime và trime hóa
Ngoài việc tác dụng với các tác nhân phản ứng, phân tử axetilen có thể tự tác dụng với nhau.
Hai phân tử axetilen cộng hợp với nhau tạo thành vinylaxetilen:
2CHΞCH CH2=CH-CΞCH
Ba phân tử axetilen cộng hợp với nhau tạo thành benzen:
3CHΞCH C6H6

Về bản chất, đây cũng là phản ứng cộng HX vào liên kết ba, với HX là H-CHΞCH.
2. Phản ứng thế bằng ion kim loại
Thí nghiệm: Sục khí axetilen vào dung dịch bạc nitrat trong amoniac, thấy có kết tủa vàng nhạt. Đó là muối bạc axetilua.
.gif)
Nhận xét: Nguyên tử hidro liên kết trực tiếp với nguyên tử cacbon liên kết ba đầu mạch có tính linh động cao hơn các nguyên tử hidro khác nên có thể bị thay thế bởi ion kim loại. Vì vậy, chỉ có các ank-1-in mới phản ứng được với dung dịch bạc nitrat trong amoniac.
Tính chất này dùng để phân biệt các ank-1-in với anken và các ankin khác.
3. Phản ứng oxi hóa
a) Phản ứng oxi hóa hoàn toàn (phản ứng cháy)
Các ankin khi cháy tỏa nhiều nhiệt, tạo thành hơi nước và khí CO2.
2CnH2n-2 + (3n-1)O2 2nCO2 + 2(n-1)H2O
Vậy khí đốt cháy ankin ta có: nCO2 > nH2O và nAnkin = nCO2 - nH2O.
b) Phản ứng oxi hóa không hoàn toàn
Tương tự anken và ankađien, ankin cũng có khả năng làm mất màu dung dịch thuốc kím KMnO4
.gif)
@128877@@129022@@128944@
IV. ĐIỀU CHẾ
Trong phòng thí nghiệm và trước đây trong công nghiệp, axetilen được điều chế bằng cách thủy phân đất đèn CaC2.
CaC2 + 2H2O → C2H2 + Ca(OH)2
Ngày nay trong công nghiệp, axetilen được sản xuất từ metan.
2CH4 2C2H2 + 3H2
.gif)
V. ỨNG DỤNG
1. Làm nhiên liệu
Khi cháy, axetilen tỏa nhiều nhiệt nên được dùng trong đèn xì oxi-axetilen để hàn, cắt kim loại.
2. Làm nguyên liệu
Từ axetilen có thể điều chế điều chế nhiều chất đầu quan trọng cho các quá trình tổng hợp hữu cơ.

Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!
Danh sách các phiên bản khác của bài học này. Xem hướng dẫn
| Nguyễn Trần Thành Đạt đã đóng góp một phiên bản khác cho bài học này (20 tháng 4 2021 lúc 19:16) | 0 lượt thích |