Bài 18: Phân loại phản ứng trong hóa học vô cơ
Nội dung lý thuyết
Các phiên bản khácI. PHẢN ỨNG CÓ SỰ THAY ĐỔI SỐ OXI HÓA VÀ PHẢN ỨNG KHÔNG CÓ SỰ THAY ĐỔI SỐ OXI HÓA
1. Phản ứng hóa hợp
Phản ứng hóa hợp là phản ứng trong đó có hai hay nhiều chất tham gia phản ứng nhưng chỉ thu được duy nhất một chất sản phẩm.
Ví dụ 1:
Ta thấy số oxi hóa của natri tăng từ 0 lên +1, số oxi hóa của clo giảm từ 0 xuống -1.
Ví dụ 2:
Trong phản ứng trên, số oxi hóa của các nguyên tố không thay đổi.
Nhận xét: Trong phản ứng hóa hợp, số oxi hóa của các nguyên tố có thể thay đổi hoặc không thay đổi.
@966583@
2. Phản ứng phân hủy
Phản ứng phân hủy là phản ứng hóa học mà chỉ có một chất tham gia phản ứng nhưng lại tạo thành nhiều sản phẩm khác nhau.

Ví dụ 1:
Số oxi hóa của oxi tăng từ -2 lên 0.
Số oxi hóa của Cl giảm từ +5 xuống +1.
Ví dụ 2:
Số oxi hóa của các nguyên tố không thay đổi.
Nhận xét: Trong phản ứng phân hủy, số oxi hóa của các nguyên tố có thể thay đổi hoặc không thay đổi.
3. Phản ứng thế
Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
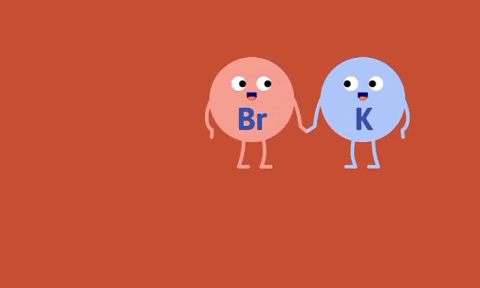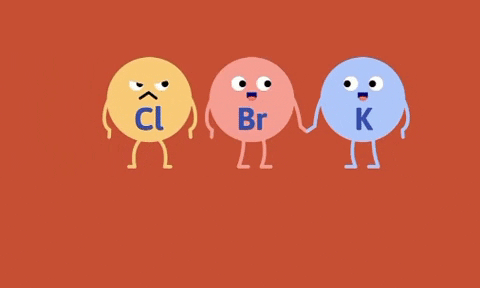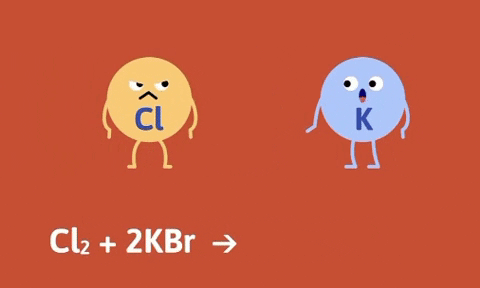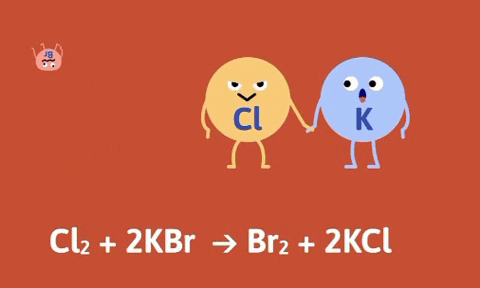
Ví dụ
Số oxi hóa của Fe, Zn tăng từ 0 lên +2, số oxi hóa của hidro và đồng giảm từ +1, +2 xuống 0.
Nhận xét: Trong phản ứng thế bao giờ cũng có sự thay đổi số oxi hóa của các nguyên tố.
4. Phản ứng trao đổi
Phản ứng trao đổi là một loại phản ứng hóa học trong đó, các chất trao đổi cho nhau thành phần cấu tạo của nó mà không làm thay đổi chỉ số oxi hóa. Từ sự trao đổi này, chúng hình thành nên những chất mới của phương trình phản ứng.

Ví dụ:
Nhận xét: Trong phản ứng trao đổi, số oxi hóa của các nguyên tố không thay đổi.
II. KẾT LUẬN
Có thể chia phản ứng hóa học thành hai loại:
- Phản ứng hóa học có sự thay đổi số oxi hóa là phản ứng oxi hóa - khử.
- Phản ứng không có sự thay đổi số oxi hóa, không phải là phản ứng oxi hóa - khử.
@966637@
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!
Danh sách các phiên bản khác của bài học này. Xem hướng dẫn
| Đức Hiếu đã đóng góp một phiên bản khác cho bài học này (21 tháng 5 2021 lúc 18:13) | 0 lượt thích |