Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Nội dung lý thuyết
Các phiên bản khácI. Tốc độ phản ứng
1. Trình bày khái niệm tốc độ phản ứng hoá học
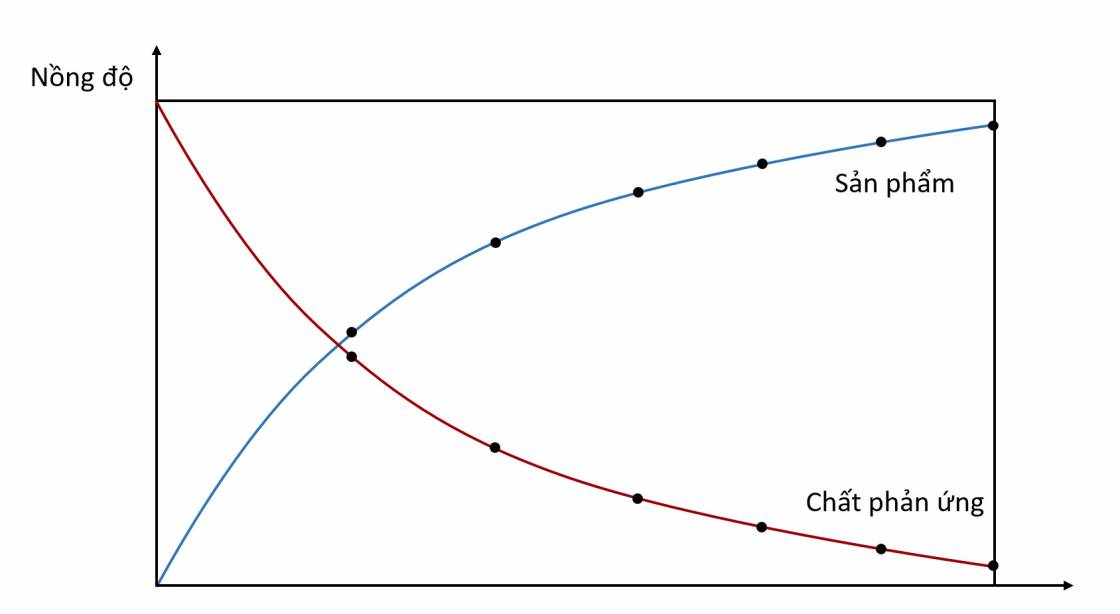
- Khái niệm tốc độ phản ứng hoá học dùng để đánh giá mức độ xảy ra nhanh hay chậm của một phản ứng.
Tốc độ phản ứng của phản ứng hoá học là đại lượng đặc trưng cho sự biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
+ Kí hiệu: \(\nu\).
+ Đơn vị: Đơn vị nồng độ/đơn vị thời gian.
- Theo thời gian, nồng độ các chất phản ứng và sản phẩm thay đổi nên tốc độ phản ứng sẽ thay đổi, vì vậy người ta sử dụng tới đại lượng tốc độ phản ứng trung bình. Ngoài ra còn có tốc độ tức thời của phản ứng, là tốc độ phản ứng tại một thời điểm nào đó.
2. Tính tốc độ trung bình của phản ứng hoá học
Tốc độ trung bình của phản ứng là tốc độ được tính trong một khoảng thời gian của phản ứng.
- Phản ứng tổng quát:
aA + bB → cC + dD
Biểu thức tính tốc độ trung bình của phản ứng là:
\(\overline{\nu}=-\dfrac{1}{a}\times\dfrac{\Delta C_A}{\Delta t}=-\dfrac{1}{b}\times\dfrac{\Delta C_B}{\Delta t}=\dfrac{1}{c}\times\dfrac{\Delta C_C}{\Delta t}=\dfrac{1}{d}\times\dfrac{\Delta C_D}{\Delta t}\)
Trong đó:
\(\overline{\nu}\) là tốc độ trung bình của phản ứng.
\(\Delta C=C_2-C_1\)là biến thiên nồng độ, được tính bằng nồng độ một chất sau khi phản ứng xảy ra trừ đi nồng độ của chất đó trước phản ứng.
\(\Delta t=t_2-t_1\) là biến thiên thời gian.
C1, C2 là nồng độ của một chất tại 2 thời điểm tương ứng là t1 và t2.
VD: Cho phản ứng
2N2O5(g) → 4NO2(g) + O2(g)
Sau thời gian từ giây 61 đến giây 120, nồng độ NO2 tăng từ 0,30M lên 0,40M. Tính tốc độ trung bình của phản ứng.
Giải:
- Biến thiên thời gian của phản ứng: \(\Delta t=t_2-t_1=120-61=59\)(giây).
- Biến thiên nồng độ của NO2 trong phản ứng: \(\Delta C_{NO_2}=0,40-0,30=0,10\) (M).
- Tốc độ trung bình của phản ứng là: \(\overline{v}=\dfrac{1}{4}\times\dfrac{0,10}{59}=4,24\times10^{-4}\) (M/giây).
@2890775@
II. Biểu thức tốc độ phản ứng
Tìm hiểu về định luật tác dụng khối lượng
Ở nhiệt độ không đổi, tốc độ phản ứng tỉ lệ với tích số nồng độ các chất tham gia phản ứng với số mũ thích hợp.
*Chỉ đúng cho các phản ứng đơn giản, đó là phản ứng một chiều, chỉ qua một giai đoạn từ chất phản ứng tạo ra sản phẩm.
- Phản ứng đơn giản có dạng:
aA + bB → cC + dD
- Mối quan hệ giữa nồng độ và tốc độ tức thời của phản ứng hoá học được biểu diễn bằng biểu thức:
\(\nu=k\times C_A^a\times C_B^b\)
Trong đó:
\(k\) là hằng số tốc độ phản ứng.
CA, CB là nồng độ (M) chất A, B tại thời điểm đang xét.
- Khi nồng độ chất phản ứng bằng đơn vị (1 M) thì \(k=\nu\), vậy \(k\) là tốc độ của phản ứng và được gọi là tốc độ riêng, đây là ý nghĩa của hằng số tốc độ phản ứng.
- Hằng số \(k\) chỉ phục thuộc vào bản chất của chất phản ứng và nhiệt độ.
VD: Cho phản ứng đơn giản xảy ra trong bình kín:
2NO(g) + O2 → 2NO2(g)
Viết biểu thức tốc độ tức thời của phản ứng.
Giải:
Biểu thức tốc độ tức thời của phản ứng trên là: \(v=k\times C^2_{NO}\times C^1_{O_2}\).
@2890859@
Các em đã học:
Phản ứng đơn giản: aA + bB → cC + dD
1. Biểu thức tính tốc độ trung bình của phản ứng hoá học:
\(\overline{\nu}=-\dfrac{1}{a}\times\dfrac{\Delta C_A}{\Delta t}=-\dfrac{1}{b}\times\dfrac{\Delta C_B}{\Delta t}=\dfrac{1}{c}\times\dfrac{\Delta C_C}{\Delta t}=\dfrac{1}{d}\times\dfrac{\Delta C_D}{\Delta t}\)
2. Biểu thức thể hiện mối quan hệ giữa nồng độ và tốc độ tức thời được tính trong một khoảng thời gian của phản ứng:
\(\nu=k\times C_A^a\times C_B^b\)