Viết phương trình hoá học của phản ứng tạo thành muối KCl và MgSO4.

Những câu hỏi liên quan
Ngâm một lá kim loại Ni trong những dung dịch muối sau : MgSO4, NaCI, CuSO4, AICI3, ZnCI2, Pb(NO3)2, AgNO3. Hãy cho biết muối nào có phản ứng với Ni. Giải thích và viết phương trình hoá học.
Đáp án:
Niken có thể phản ứng được với các dung dịch muối của kim loại đứng sau nó trong dãy điện hóa:
Ni+CuSO4→NiSO4+Cu↓Ni+CuSO4→NiSO4+Cu↓
Ni+Pb(NO3)2→Ni(NO3)2+Pb↓Ni+Pb(NO3)2→Ni(NO3)2+Pb↓
Ni+2AgNO3→Ni(NO3)2+2Ag↓
Đúng 0
Bình luận (0)
Ngâm một lá kim loại Ni trong những dung dịch muối sau: MgSO4, NaCl, CuSO4, AlCl3, ZnCl2, Pb(NO3)2, AgNO3. Hãy cho biết muối nào có phản ứng với Ni. Giải thích và viết phương trình hoá học.
Niken có thể phản ứng được với các dung dịch muối sau đây:
Ni + CuSO4 → NiSO4 + Cu↓
Ni + Pb(NO3)2 → Ni(NO3)2 + Pb↓
Ni + 2AgNO3 → Ni(NO3)2 + 2Ag↓
Đúng 0
Bình luận (0)
Cho các dung dịch
CuSO
4
,
FeSO
4
,
MgSO
4
,
AgNO
3
và các kim loại Cu, Fe, Mg, Ag. Theo em những cặp chất nào (kim loại và muối) phản ứng được với nhau ? Viết các phương trình hoá học.
Đọc tiếp
Cho các dung dịch CuSO 4 , FeSO 4 , MgSO 4 , AgNO 3 và các kim loại Cu, Fe, Mg, Ag. Theo em những cặp chất nào (kim loại và muối) phản ứng được với nhau ? Viết các phương trình hoá học.
- Viết phương trình hoá học của phản ứng giữa Mg với các dung dịch CuSO 4 , FeSO 4 và AgNO 3 .
Mg + FeSO 4 → MgSO 4 + Fe
Mg + CuSO 4 → MgSO 4 + Cu
Mg + AgNO 3 → Mg NO 3 2 + Ag
- Viết phương trình hoá học của phản ứng giữa Fe với các dung dịch CuSO 4 , AgNO 3
Fe + CuSO 4 → FeSO 4 + Cu
Fe + 2 AgNO 3 → Fe NO 3 2 + 2Ag
- Viết phương trình hoá học của phản ứng giữa Cu với dung dịch AgNO 3
Cu + AgNO 3 → Cu NO 3 2 + Ag
Đúng 0
Bình luận (0)
Viết phương trình hoá học của phản ứng oxi hoá propan – 1 – ol bằng CuO, tạo thành aldehyde.
\(CH_3CH_2CH_2OH+CuO\rightarrow CH_3CH_2CHO+Cu+H_2O\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 6,2 gam photpho trong oxi dư. Cho sản phẩm tạo thành tác dụng vừa đủ với dung dịch NaOH 32% tạo ra muối Na2HPO4. Viết phương trình hoá học của các phản ứng xảy ra?
Phương trình phản ứng:
4P + 5O2 → 2P2O5 (1)
P2O5 + 4NaOH → 2Na2HPO4 + H2O (2)
Đúng 0
Bình luận (0)
Trình bày phương pháp hoá học phân biệt 4 chất rắn là KCL ,K2CO3,CaCO3 và BaSO4 .Viết phương trình phản ứng xảy ra
Trích mẫu thử
Cho mẫu thử vào nước :
- mẫu thử nào tan là $KCl,K_2CO_3$ - nhóm 1
- mẫu thử nào không tan là $CaCO_3,BaSO_4$ - nhóm 2
Cho dung dịch $HCl$ vào nhóm 1 :
- mẫu thử nào tạo khí không màu không mùi là $K_2CO_3$
$K_2CO_3 + 2HCl \to 2KCl + CO_2 + H_2O$
- mẫu thử không hiện tượng gì là $KCl$
Cho dung dịch $HCl$ vào nhóm 2 :
- mẫu thử nào tạo khí không màu không mùi là $CaCO_3$
$CaCO_3 + 2HCl \to CaCl_2 + CO_2 + H_2O$
- mẫu thử không hiện tượng gì là $BaSO_4$
Đúng 0
Bình luận (0)
Viết phương trình hoá học của phản ứng tạo thành liti nitrua và nhóm nitrua khi cho liti và nhôm tác dụng trực tiếp với nitơ. Trong các phản ứng này nitơ là chất oxi hoá hay chất khử?
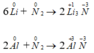
Ta thấy trong các phản ứng trên nitơ là chất oxi hoá vì 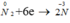
Đúng 0
Bình luận (0)
Dùng 500 ml dung dịch H2SO4 1,2 m để hoà tan hết lượng kim loại sắt. Phản ứng tạo thành sắt (II) sunfat và khí hiđro: a) Viết phương trình hoá học của phản ứng? b) Tính khối lượng muối sắt (II) sunfat thu được? c) Tính thể tích khí H2 thoát ra (Ở ĐKTC)? d) Dẫn toàn bộ khí H2 thu được ở trên qua bột CuO đun nóng. Tính khối lượng điều chế được?
Đọc tiếp
Dùng 500 ml dung dịch H2SO4 1,2 m để hoà tan hết lượng kim loại sắt. Phản ứng tạo thành sắt (II) sunfat và khí hiđro: a) Viết phương trình hoá học của phản ứng? b) Tính khối lượng muối sắt (II) sunfat thu được? c) Tính thể tích khí H2 thoát ra (Ở ĐKTC)? d) Dẫn toàn bộ khí H2 thu được ở trên qua bột CuO đun nóng. Tính khối lượng điều chế được?
a) PTHH : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b) \(n_{H_2SO_4}=C_MV=1,2\cdot0,5=0,6\left(mol\right)\)
PTHH : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,6 0,6 0,6
\(\Rightarrow m_{FeSO_4}=n_{FeSO_4}M_{FeSO_4}=0,6\cdot152=91,2\left(g\right)\)
c) Từ câu b \(\Rightarrow n_{H_2}=0,6\left(mol\right)\)
\(\Rightarrow V_{H_2}=n_{H_2}.22,4=0,6\cdot22,4=13,44\left(l\right)\)
d) PTHH : \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
0,6 0,6
\(\Rightarrow m_{Cu}=n_{Cu}M_{Cu}=0,6\cdot64=38,4\left(g\right)\)
Đúng 2
Bình luận (0)
a)\(PTHH:Fe+H_2SO_4\xrightarrow[]{}FeSO_4+H_2\)
b)Đổi 500ml = 0,5l
Số mol của H2SO4 là:
\(C_{MH_2SO_4}=\dfrac{n_{H_2SO_4}}{V_{H_2SO_{\text{4 }}}}\Rightarrow n_{H_2SO_4}=C_{MH_2SO_4}.V_{H_2SO_4}=1,2.0,5=0,6\left(mol\right)\)
\(PTHH:Fe+H_2SO_4\xrightarrow[]{}FeSO_4+H_2\)
Tỉ lệ : 1 1 1 1 (mol)
Số mol : 0,6 0,6 0,6 0,6(mol)
Khối lượng sắt(II)sunfat thu được là:
\(m_{FeSO_4}=n_{FeSO_4}.M_{FeSO_{\text{4 }}}=0,6.152=91,2\left(g\right)\)
c) Thể tích khí H2 thoát ra là:
\(V_{H_2}=n_{H_2}.22,4=0,6.22,4=13,44\left(l\right)\)
d)\(PTHH:CuO+H_2\xrightarrow[]{t^0}Cu+H_2O\)
tỉ lệ :1 1 1 1 (mol)
số mol :0,6 0,6 0,6 0,6 (mol)
Khối lượng CuO điều chế được là:
\(m_{CuO}=n_{CuO}.M_{CuO}=0,6.80=48\left(g\right)\)
Đúng 1
Bình luận (2)
Khi phân hủy hoàn toàn 24,5 gam muối Kali clorat KClO3, thu được 9,6 gam khí oxi và muối Kali clorua KCl a. Lập phương trình hóa học của phản ứng b. Viết công thức về khối lượng của phản ứng c. Tính khối lượng muối kali clorua KCl thu được?
\(2KClO_3\rightarrow3O_2+2KCl\)
\(m_{KClO_3}=m_{O_2}+m_{KCl}\)
\(\Rightarrow m_{KCl}=m_{KClO_3}-m_{KCl}=24,5-9,6=14,9\left(g\right)\)
Đúng 2
Bình luận (1)


















