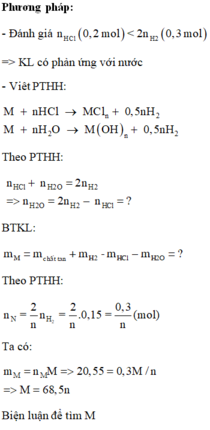Cho 2,16g kim loại A(III) tan vào dung dịch chứa 11,76g Axit Sunfuric thì vừa đủ. Sau PƯ xảy ra xong thì: a) Điều chế được mấy lít H2(ĐKTC)? Thu được mấy bình khí H2 dung tích 50ml , biết khi thu H2 bị hao hụt 30%. b) A là kim loại gì? c) Dung dịch sau PƯ chứa chất gì? Mấy gam?

Những câu hỏi liên quan
cho 2,16 g nhôm tan hết vào 250g dung dịch chứa 19,6% về khối lượng axit sunfuric. sau PƯ xảy ra xong thì
a) điều chế được mấy lít H2 (đktc)? Thu đươc mấy bình khí h2 dung tích 50ml, biết khi thu H2 bị hao hụt 30%
b)dung dịch sau PƯ chứa chất gì? Mấy gam?
a)nAl=2,16/27=0,08(mol)
mH2SO4=250.19,6/100=49(g)
nH2SO4=49/98=0,5(mol)
2Al+3H2SO4--->Al2(SO4)3+3H2
lập tỉ số: nAl=0,08/2=0,04
nH2SO4=0,5/3=0,167
vì 0,04<0,167=>H2SO4 dư và Al hết
theo PTHH: nH2=1,5nAl=1,5.0,08=0,12(mol)
VH2(đktc)=22,4.012=2,688(l)
thể tích H2 còn lại là:
VH2(còn lại)=2,688-2,688.30/100=1,8816(l)
số bình khí H2 50 ml cần dùng là:
1,8816/0,05=37,632
vì bình luôn luôn phải là số nguyên
=>cần 38 bình
b)dung dịch sau phản ứng gồm Al2(SO4)3 và H2SO4 dư
theo PTHH: nH2SO4=1,5nAl=1,5.0,08=0,12(mol)
nAl2(SO4)3=0,5nAl=0,5.0,08=0,04(mol)
nH2SO4(dư)=0,5-0,12=0,38(mol)
mAl2(SO4)3=0,04.342=13,68(g)
mH2SO4=98.0,38=37,24(g)
Cho 19.5g Zn tan hết trong dung dịch cho 49g H2SO4 . Sau phản ứng xong thì
a) Điều chế được mấy lít khí H2 (đktc)
b) Dung dịch sau phản ứng chứa chất gì ? Mấy gam
c) Lượng H2 sau phản ứng trên đem khứ CuO thì thu được mấy gam Cu
giúp mik vs ạ! mik cần gấp ạ
nZn = 19,5/65 = 0,3 (mol)
nH2SO4 = 49/98 = 0,5 (mol)
PTHH: Zn + H2SO4 -> ZnSO4 + H2
LTL: 0,3 < 0,5 => H2SO4 dư
nH2SO4 (phản ứng) = mZnSO4 = 0,3 (mol)
mH2SO4 (dư) = (0,5 - 0,3) . 98 = 19,6 (g)
mZnSO4 = 0,3 . 161 = 48,3 (g)
PTHH: CuO + H2 -> (t°) Cu + H2O
Mol: 0,3 <--- 0,3 ---> 0,3
mCu = 0,3 . 64 = 19,2 (g)
Đúng 1
Bình luận (0)
Hòa tan kim loại M vào 200 ml dung dịch HCl 1M, sau khi các phản ứng xảy ra hoàn toàn, thu được 3,36 lít khí
H
2
(đktc) và dung dịch X chứa 29,35 gam chất tan. Kim loại M là A. Na B. Ba C. K D. Al
Đọc tiếp
Hòa tan kim loại M vào 200 ml dung dịch HCl 1M, sau khi các phản ứng xảy ra hoàn toàn, thu được 3,36 lít khí H 2 (đktc) và dung dịch X chứa 29,35 gam chất tan. Kim loại M là
A. Na
B. Ba
C. K
D. Al
Hoà tan hoàn toàn 16,6 gam hỗn hợp bột X gồm Al và Fe trong dung dịch axit sunfuric vừa đủ sau phản ứng thấy có 64,6 gam muối khan được tạo ra và thu được V lít khí H2(đktc)
a) tính % theo khối lượng mỗi kim loại có trong X
b) tính V khí hiđro
Xem chi tiết
Đặt :
nAl = a (mol)
nFe = b(mol)
mX = 27a + 56b = 16.6 (g) (1)
2Al + 3H2SO4 => Al2(SO4)3 + 3H2
Fe + H2SO4 => FeSO4 + H2
mM = 342a + 152b = 64.6 (g) (2)
(1) , (2):
a = 4/55
b = 23/88
%Al = (4/55*27) / 16.6 *100% = 11.83%
%Fe = 100 - 11.83 = 88.17%
nH2 = 3/2a + b = 3/2 * 4/55 + 23/88 = 163/440 (mol)
VH2 = 8.3 (l)
Đúng 2
Bình luận (0)
Hòa tan 10,8g một kim loại hóa trị (III) trong dung dịch HCl 14,6% vừa đủ thì thu được 13,44 lít H2(đktc).
a. Xác định kim loại phản ứng.
b. Tính khối lượng dung dịch HCl 14,6% đã dùng.
Gọi KL là R
\(n_{H_2}=\dfrac{13,44}{22,4}=0,6(mol)\\ a,2R+6HCl\to 2RCl_3+3H_2\\ \Rightarrow n_R=0,4(mol)\\ \Rightarrow M_R=\dfrac{10,8}{0,4}=27(g/mol)(Al)\\ b,n_{HCl}=1,2(mol)\\ \Rightarrow m_{dd_{HCl}}=\dfrac{1,2.36,5}{14,6\%}=300(g)\)
Đúng 3
Bình luận (0)
cho 2,7 g kim loại R vào v lít dung dịch hcl sau pư thu được 3,36 lít khí H2 tương tự cho 4,05 kim loại R trên cho vào V l dung dịch hcl như trên sau pư thu được 4,48 lít khí h2 trong 2 pư trên pư nào dùng hết axit pư nào còn dư vì sao
giúp mik với cần gấp
nH2= 3,36/22,4=0,15 mol
TH1 R có hóa trị 1
2R + 2HCl --> 2RCl + H2
0,3 0,15 mol
M R = 2,7/0,3= 9 => Be (ktm vì Be hóa trị 2)
TH2 R có hóa trị 2
R + 2HCl --> RCl2 + H2
0,15 0,15 mol
M R =2,7/0,15=Ar (ktm vì Ar là khí hiếm )
TH3 R có hóa trị 3
2R + 6HCl --> 2RCl3 + 3H2
0,1 0,15 mol
M R =2,7/0,1=27 (thỏa mãn ) => R là Al
pthh 2Al + 6HCl --> 2AlCl3 + 3H2 (1)
0,1 0,3 mol
=> V HCl = 0,3*22,4=6,72 l
nAl = 4,05/27=0,15 mol : n H2=4,48/22,4=0,2 mol
pthh 2Al + 6HCl --> 2AlCl3 + 3H2 (2)
2/15 0,2 mol
ta thấy nAl/2 > nH2/3 => Al dư , H2 hết
(2)=> mAl = 2/15*27=3,6 g
=> phản ứng (2) HCl hết , phản ứng (1) HCl dư
Đúng 0
Bình luận (0)
hoà tan hoàn toàn m gam hỗn hợp hai kim loại A và B bằng dung dịch HCL vừa đủ thu được 8,96 lít khí H2 ở đktc cô cạn dung dịch sau phản ứng thì thu được 39,4 gam hỗn hợp muối khan tính m
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
=> nHCl = 0,8 (mol)
Theo ĐLBTKL: mA,B + mHCl = mmuối + mH2
=> mA,B = 39,4 + 0,4.2 - 0,8.36,5 = 11 (g)
Đúng 2
Bình luận (1)
Hòa tan hoàn toàn 5,85 gam hỗn hợp gồm một kim loại hóa trị II và một kim loại hóa trị III vào dung dịch HCl dư thu được 3,024 lít H2 (đktc).
a/ Cô cạn dung dịch thu được bao nhiêu gam muối khan?
b/ Tính thể tích H2 thoát ra ở đktc.
c/ Nếu biết kim loại hóa trị III là Al và số mol bằng 1/3 lần số mol kim loại hóa trị II. Tìm kim loại hóa trị II.
a) \(n_{H_2}=\dfrac{3,024}{22,4}=0,135\left(mol\right)\)
=> nHCl = 0,27 (mol)
Theo ĐLBTKL: mkim loại + mHCl = mmuối + mH2
=> mmuối = 5,85 + 0,27.36,5 - 0,135.2 = 15,435 (g)
b) VH2 = 3,024 (l) (Theo đề bài)
c)
Hỗn hợp kim loại gồm \(\left\{{}\begin{matrix}Al:a\left(mol\right)\\X:3a\left(mol\right)\end{matrix}\right.\)
=> 27a + MX.3a = 5,85
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a----------------------->1,5a
X + 2HCl --> XCl2 + H2
3a------------------->3a
=> 1,5a + 3a = 0,135
=> a = 0,03 (mol)
=> MX = 56 (g/mol)
=> X là Fe
Đúng 2
Bình luận (0)
Câu 8 : Hòa tan xảy ra phản ứng : a . Hòa tan 11,16 gam Na2O vào 88,84 gam HọO thu được dung dịch X. Tính nồng độ % của dung djch X ? b . Hòa tan 4,48 gam Fe vào dung dịch HCl 7,3 % vừa đủ thu được dung dịch X và khí H2 - Tính thể tích khí H2 ( đktc ) ? - Tính khối lượng dung dịch HCl đã dùng ? - Tính nồng độ % của dung dịch X ?
a) \(Na_2O+H_2O\rightarrow2NaOH\)
\(n_{NaOH}=2n_{Na_2O}=2.\dfrac{11,16}{62}=0,32\left(mol\right)\)
\(C\%_{NaOH}=\dfrac{0,32.40}{11,16+88,84}.100=12,8\%\)
b) \(n_{Fe}=\dfrac{4,48}{56}=0,08\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{H_2}=n_{Fe}=0,08\left(mol\right)\\ \Rightarrow V_{H_2}=0,08.22,4=1,792\left(lít\right)\)
\(n_{HCl}=2n_{Fe}=0,16\left(mol\right)\)
\(m_{ddHCl}=\dfrac{0,16.36,5}{7,3\%}=80\left(g\right)\)
\(n_{FeCl_2}=n_{Fe}=0,08\left(mol\right)\\ m_{ddsaupu}=4,48+80-0,08.2=84,32\left(g\right)\)
\(C\%_{FeCl_2}=\dfrac{0,08.127}{84,32}.100=12,05\%\)
Đúng 0
Bình luận (0)