Hãy cho biết thành phần trăm theo thể tích các chất khí có trong không khí

Những câu hỏi liên quan
Biểu đồ ở Hình 36 biểu diễn tỉ lệ theo thể tích trong không khí của: khí oxygen; khí nitrogen; hơi nước, khí carbonic và các khí khác.Quan sát biểu đồ các thành phân của không khí ở Hình 36 và cho biết trong không khí, có bao nhiêu phần trăm là:a) Khí nitrogen;b) Khí oxygen;c) Hơi nước, khí carbonic và các khí khác.
Đọc tiếp
Biểu đồ ở Hình 36 biểu diễn tỉ lệ theo thể tích trong không khí của: khí oxygen; khí nitrogen; hơi nước, khí carbonic và các khí khác.
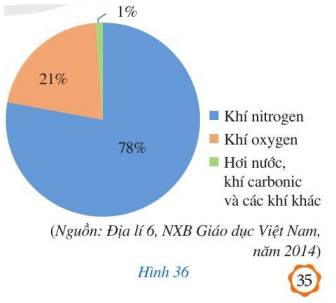
Quan sát biểu đồ các thành phân của không khí ở Hình 36 và cho biết trong không khí, có bao nhiêu phần trăm là:
a) Khí nitrogen;
b) Khí oxygen;
c) Hơi nước, khí carbonic và các khí khác.
a) Khí nitrogen: 78%
b) Khí oxygen: 21%
c) Hơi nước, khí carbonic và các khí khác: 1%
Đúng 0
Bình luận (0)
Cho biết thành phần phần trăm thể tích các khí trong không khí ? Nêu vai trò của không
khí đối với sự sống ? Nêu các nguyên nhân gây ô nhiễm không khí ? Ô nhiễm không khí có tác
hại gì đối với đời sống ? Em có thể làm gì đề góp phần làm giảm ô nhiễm không khí ?
có hỗn hợp khí oxi và ozon . Sau một thời gian , ozon bị phân hủy hết , ta được một chất khí duy nhất có thể tích tăng thêm 2% ( phương trình hóa học là : 203 tạo thành 302 ) : a) hãy giải thích sự gia tăng thể tích hỗn hợp khí ; b) Xác định thành phần phần trăm theo thể tích của hỗn hợp khí ban đầu .( Biết các thể tích khí được đo ở cùng điều kiện nhiệt độ , áp suất ).
Đọc tiếp
có hỗn hợp khí oxi và ozon . Sau một thời gian , ozon bị phân hủy hết , ta được một chất khí duy nhất có thể tích tăng thêm 2% ( phương trình hóa học là : 203 tạo thành 302 ) : a) hãy giải thích sự gia tăng thể tích hỗn hợp khí ; b) Xác định thành phần phần trăm theo thể tích của hỗn hợp khí ban đầu .
( Biết các thể tích khí được đo ở cùng điều kiện nhiệt độ , áp suất ).
Đặt x và y lần lượt là số mol của O2 và O3 trong hỗn hợp
2O3 -> 3O2
y 1,5y
Trước phản ứng (x + y) mol hỗn hợp.
Sau phản ứng (x + 1,5y) mol.
Số mol tăng là (x + 1,5y) – (x + y) = 0,5y.
b) 0,5y tương ứng với 2% => y tương ứng với 4%.
Vậy thành phần phần trăm khí oxi là 96% và ozon là 4%.
Đúng 0
Bình luận (0)
Có hỗn hợp khí oxi và ozon. Sau một thời gian, ozon bị phân hủy hết, ta được một chất khí duy nhất có thể tích tăng thêm 2%. Thành phần phần trăm theo thể tích ozon hỗn hợp khí ban đầu là (biết các thể tích khí được đo ở cùng điều kiện nhiệt độ, áp suất) A. 2,00%. B. 4,00%. C. 96,00%. D. 98,00%.
Đọc tiếp
Có hỗn hợp khí oxi và ozon. Sau một thời gian, ozon bị phân hủy hết, ta được một chất khí duy nhất có thể tích tăng thêm 2%. Thành phần phần trăm theo thể tích ozon hỗn hợp khí ban đầu là (biết các thể tích khí được đo ở cùng điều kiện nhiệt độ, áp suất)
A. 2,00%.
B. 4,00%.
C. 96,00%.
D. 98,00%.
Đáp án B
Phương trình hóa học: 2 O 3 → 3 O 2
Theo phương trình thì 2 phân tử O3 mất đi sẽ sinh ra 3 phân tử O 3 Số phân tử khí tăng = 3 - 2 = 1 => Số phân tử O3 mất đi = 2 lần số phân tử khí tăng

Phần trăm thể tích O3 trong hỗn hợp ban đầu là:
![]()
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 15,6 gam hỗn hợp gồm Mg và Ag trong không khí thu được 18,8 g hỗn hợp chất rắn.
a) viết PTHH xảy ra
b) tính thể tích không khí cần dùng ở đktc biết rằng thể tích oxi chiếm 20% thể tích không khí
c) tính thành phần phần trăm các kim loại trong hỗn hợp ban đầu
Xem chi tiết
a. Ag không phản ứng nên ta có PTHH: \(2Mg+O_2\rightarrow^{t^o}2MgO\)
\(\rightarrow m_{O_2}=m_{hh}-m_{\mu\text{ối}}=18,8-15,6=3,2g\)
\(\rightarrow n_{O_2}=\frac{3,2}{32}=0,1mol\)
b. \(\rightarrow V_{O_2}=n.22,4=22,4.0,1=2,24l\)
\(\rightarrow V_{kk}=4,48.5=11,2l\)
c. Có \(n_{Mg}=2n_{O_2}=0,2l\)
\(\rightarrow m_{Mg}=0,2.24=4,8g\)
\(\rightarrow\%m_{Mg}=\frac{4,8.100}{15,6}\approx30,77\%\)
\(\rightarrow\%m_{Ag}=100\%-30,77\%=69,23\%\)
Dẫn 13,56 lít hỗn hợp 2 khí metan và etylen qua bình đựng dung dịch brom dư sao cho phản ứng xảy ra hoàn toàn , chất khí sau phản ứng đem đốt dẫn toàn bộ khí thu được qua vôi trong dư tạo thành 40g chất không tan màu trắng . Tính thành phần phần trăm theo thể tích của mỗi khí có trong hỗn hợp ban đầu .
Cho hỗn hợp qua dung dịch brom dư
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Khí thoát ra là \(CH_4\)
\(CH_4+2O_2\rightarrow^{t^o}CO_2+2H_2O\)
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
Ta có:
\(n_{CaCO_3}=\frac{40}{100}=0,4mol=n_{CO_2}=n_{CH_4}\)
\(\rightarrow V_{CH_4}=0,4.22,4=8,96l\)
\(\rightarrow\%V_{CH_4}=\frac{8,96}{13,56}=66\%\rightarrow\%V_{C_2H_4}=34\%\)
Có hỗn hợp khí oxi và ozon. Sau một thời gian, khí ozon bị phân hủy hết, ta được một chất khí duy nhất có thể tích tăng thêm 2%.
Phương trình hóa học là: 2O3 → 3O2
Xác định thành phần phần trăm theo thể tích của hỗn hợp khí ban đầu. Biết các thể tích khí được đo cùng điều kiện nhiệt độ, áp suất
Ta có; 0,5y ứng với 2% nên y ứng với 4%
Vậy O3 chiếm 4%, O2 chiếm 96%.
Đúng 0
Bình luận (0)
Đối cháy 24,8 gam phốt pho bằng 67,2 lít không khí ở điều kiện tiêu chuẩn (không khí có chứa 20% khí oxy và 80% khí nitơ về thể tích). a) Tính khối lượng sản phẩm tạo thành? b) Tính thành phần phần trăm về khối lượng các chất có trong hỗn hợp sau phản ứng? Biết rằng khí nitơ không cháy.
$\rm a)n_{kk} = \dfrac{67,2}{22,4} = 3 (mol)$
$\rm \Rightarrow n_{O_2} = 20\%.3 = 0,6 (mol)$
$\rm n_P = \dfrac{24,8}{31} = 0,8 (mol)$
PTHH: \(\rm 4P + 5O_2 \xrightarrow{t^o} 2P_2O_5 \)
Ban đầu: 0,8 0,6
Pư: 0,48<--0,6
Sau pư: 0,32 0 0,24
$\rm \Rightarrow m_{\text{sản phẩm tạo thành}} = m_{P_2O_5(sinh.ra)} = 0,24.142 = 34,08 (g)$
$\m b) m_{hh} = m_{P(dư)} + m_{P_2O_5} = 0,32.31 + 34,08 = 44 (g)$
$\rm \Rightarrow \%m_P = \dfrac{0,32.31}{44} .100\% = 22,545\%$
$\rm \Rightarrow \%m_{P_2O_5} = 100\% - 22,545\% = 77,455\%$
Đúng 2
Bình luận (0)
\(n_P=\dfrac{24,8}{31}=0,8\left(mol\right)\)
Thể tích Oxi trong 67,2 lít không khí :
67,2 x 20% = 13,44(l)
\(n_{O_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH :
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
Trc p/ư: 0,8 0,6 (mol)
p/ư 0,48 0,6 0,24
Sau p/ư: 0,32 0 0,24
=> Sau p/ư P dư
Khối lượng sản phẩm tạo thành :
\(m_{P_2O_5}=0,24.142=34,08\left(g\right)\)
Khối lượng P trong hỗn hợp :
\(m_{P\left(P_2O_5\right)}=0,48.31=14,88\left(g\right)\)
Thành phần % của P :
\(14,88:34,08=43,66\%\)
Đúng 1
Bình luận (0)
Cho 0, 672 lít hỗn hợp etilen và axetilen (đktc) vào dd Br2 dư sau phản ứng có 8,8g hợp chất brom được tạo thành. Tính thành phần phần trăm theo thể tích các khí có trong hỗn hợp.
Gọi số mol C2H4, C2H2 là a, b (mol)
=> a + b = \(\dfrac{0,672}{22,4}=0,03\left(mol\right)\) (1)
PTHH: C2H4 + Br2 --> C2H4Br2
a-------------->a
C2H2 + 2Br2 --> C2H2Br4
b----------------->b
=> 188a + 346b = 8,8 (2)
(1)(2) => a = 0,01 (mol); b = 0,02 (mol)
=> \(\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,01}{0,03}.100\%=33,33\%\\\%V_{C_2H_2}=\dfrac{0,02}{0,03}.100\%=66,67\%\end{matrix}\right.\)
Đúng 3
Bình luận (0)





















