Tính số mol của những chất sau :
a) 3,2 gam khí metan CH4
b) 8,96 lít khí sunfurơ SO2 ( đktc )

Những câu hỏi liên quan
Câu 2. (3đ) Hãy tính: a) Số mol của: 3,2 gam SO2; 3,36 lít khí CO2 (đktc) b) Tính khối lượng của: 1,344 lít khí Clo (ở đktc) ; 0,5 mol Na2CO3 c) Tính thể tích (đktc) của: 0,25 mol N2; 4,8 g khí Oxi
a)
\(n_{SO_2}=\dfrac{m}{M}=\dfrac{3,2}{64}=0,05\left(mol\right)\\ n_{CO_2}=\dfrac{V_{\left(\text{đ}ktc\right)}}{22,4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
b)
\(n_{Cl_2}=\dfrac{V_{\left(\text{đ}ktc\right)}}{22,4}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\Rightarrow m_{Cl_2}=n.M=0,06.71=4,26\left(mol\right)\\ n_{Na_2CO_3}=n.M=0,5.106=53\left(g\right)\)
c)
\(V_{N_2\left(\text{đ}ktc\right)}=n.22,4=0,25.22,4=5,6\left(l\right)\\ n_{O_2}=\dfrac{m}{M}=\dfrac{4,8}{32}=0,15\left(mol\right)\Rightarrow V_{O_2\left(\text{đ}ktc\right)}=n.22,4=0,15.22,4=3,36\left(l\right)\)
Đúng 0
Bình luận (3)
Đốt cháy quặng kẽm sunfua (ZnS), chất này tác dụng với oxi tạo thành kẽm oxit ZnO và khí sunfurơ SO2.
a/ Viết PTHH.
b/ Cho 19,4 gam ZnS tác dụng với 8,96 lít khí oxi (đktc) thu được chất rắn A và hỗn hợp khí B.
- Tính khối lượng A.
- Cho biết thành phần khí B và tính tỉ khối của B đối với không khí
\(a,PTHH:2ZnS+3O_2\underrightarrow{t^O}2ZnO+2SO_2\)
\(n_{ZnS}=\dfrac{19,4}{97}=0,2\left(mol\right)\\
n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
\(pthh:2ZnS+3O_2\underrightarrow{t^O}2ZnO+2SO_2\)
LTL:\(\dfrac{0,2}{2}< \dfrac{0,4}{3}\)
=> O2 dư
theo pthh: \(n_{SO_2}=n_{ZnO}=n_{Zn}=0,2\left(mol\right)\)
\(m_A=m_{ZnO}=0,2.81=16,2\left(g\right)\)
Khí B gồm 1 nguyên tử S và 2 nguyên tử O
dB/kk = \(\dfrac{64}{29}\)
Đúng 1
Bình luận (0)
Bài 7: Đốt cháy hoàn toàn 3,2 gam hợp chất A cần 8,96 lít khí O2 (đktc) thu được khí CO2 và H2O theo tỉ lệ mol là 1:2.
a. Tính khối lượng của từng nguyên tố trong hợp chất A.
b. Xác định CTPT của hợp chất A biết M = 16.
a)
Do \(\dfrac{n_{CO_2}}{n_{H_2O}}=\dfrac{1}{2}\)
=> \(\dfrac{n_C}{n_H}=\dfrac{1}{4}\)
Giả sử A có CTHH là CxH4xOy
Gọi số mol của A là a (mol)
=> 12ax + 4ax + 16ay = 3,2
=> ax + ay = 0,2 (1)
Bảo toàn C: nCO2 = ax (mol)
Bảo toàn H: nH2O = 2ax (mol)
\(n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Bảo toàn O: \(ay+0,4.2=2ax+2ax\)
=> 4ax - ay = 0,8 (2)
(1)(2) => ax = 0,2 (mol); ay = 0 (mol)
=> A chỉ chứa C và H
\(\left\{{}\begin{matrix}n_C=ax\left(mol\right)\\n_H=4ax\left(mol\right)\end{matrix}\right.\)
\(\left\{{}\begin{matrix}m_C=12.ax=2,4\left(g\right)\\m_H=1.4ax=0,8\left(g\right)\end{matrix}\right.\)
b)
Xét \(\dfrac{n_C}{n_H}=\dfrac{1}{4}\)
=> CTPT: (CH4)n
Mà M = 16 g/mol
=> n = 1
=> CTPT: CH4
Đúng 1
Bình luận (0)
Bài toán công thức chuyển đổi giữa khối lượng, thể tích và lượng chất8.1. Tính số mol có trong:a. 108g nước b. 8g khí oxi c. 3,36 lít khí CO2 (đktc) d. 8,96 lít khí O2 (đktc)8.2. Hãy tính khối lượng của những lượng chất sau:a. 0,1 mol phân tử N2 b. 0,8 mol phân tử H2SO48.3. Hãy tính thể tích khí (đktc) của:a. 0,125 mol khí NO2 b. 0,6 mol khí H2
Đọc tiếp
Bài toán công thức chuyển đổi giữa khối lượng, thể tích và lượng chất
8.1. Tính số mol có trong:
a. 108g nước b. 8g khí oxi c. 3,36 lít khí CO2 (đktc) d. 8,96 lít khí O2 (đktc)
8.2. Hãy tính khối lượng của những lượng chất sau:
a. 0,1 mol phân tử N2 b. 0,8 mol phân tử H2SO4
8.3. Hãy tính thể tích khí (đktc) của:
a. 0,125 mol khí NO2 b. 0,6 mol khí H2
Bài 4. Tính thể tích (đo ở đktc) của: a) 0,5 mol SO2 b) 3,2 g CH4 c) 0,9.1023 phân tử khí N2
Bài 5. Tính khối lượng của: a) 0,1 mol Al b) 0,3 mol Cu(NO3)2 ; c) 1,2.1023 phân tử Na2CO3 d) 8,96 lít CO2 (đktc) ; e) Mỗi nguyên tố có trong 0,5 mol K2CO3
cứu mình cần gấp
4.
a) \(V_{SO_2}=0.5\cdot22.4=11.2\left(l\right)\)
b) \(V_{CH_4}=\dfrac{3.2}{16}\cdot22.4=4.48\left(l\right)\)
c) \(V_{N_2}=\dfrac{0.9\cdot10^{23}}{6\cdot10^{23}}\cdot22.4=3.36\left(l\right)\)
5.
a) \(m_{Al}=0.1\cdot27=2.7\left(g\right)\)
b) \(m_{Cu\left(NO_3\right)_2}=0.3\cdot188=56.4\left(g\right)\)
c) \(m_{Na_2CO_3}=\dfrac{1.2\cdot10^{23}}{6\cdot10^{23}}\cdot106=21.2\left(g\right)\)
d) \(m_{CO_2}=\dfrac{8.96}{22.4}\cdot44=17.6\left(g\right)\)
e) \(m_K=0.5\cdot2\cdot39=39\left(g\right)\\ m_C=0.5\cdot12=6\left(g\right)\\ m_O=0.5\cdot3\cdot16=24\left(g\right)\)
Đúng 2
Bình luận (1)
1.Tính số mol của: a. 7,3 gam HCl b. 8,96 lít khí CH4 ở đktc c. 15.1023 phân tử H2O
2.Cho biết 2,24 lít khí A ở đktc có khối lượng là 3 gam
a. Tính khối lượng mol của khí A b. Tính tỉ khối của A so với Oxi
1)
a) \(n_{HCl}=\dfrac{7,3}{36,5}=0,2\left(mol\right)\)
b) \(n_{CH_4}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
c) \(n_{H_2O}=\dfrac{15.10^{23}}{6.10^{23}}=2,5\left(mol\right)\)
2)
a) \(n_A=\dfrac{2,24}{22,4}=0,1\left(mol\right)\) => MA = \(\dfrac{3}{0,1}=30\left(g/mol\right)\)
b) \(d_{A/O_2}=\dfrac{30}{32}=0,9375\)
Đúng 0
Bình luận (0)
Câu 14: (1.5đ). Cho 3,2 gam lưu huỳnh cháy trong khí oxi sau phản ứng thu được khí sunfurơ (SO2 ) a. Lập phương trình phản ứng? b. Tính khối lượng oxi tham gia phản ứng và thể tích SO2 sinh ra ở (đktc). Cho biết : S =32 ; O2 =16
a) $S + O_2 \xrightarrow{t^o} SO_2$
b)
Theo PTHH :
$n_{O_2} = n_{SO_2} = n_S = \dfrac{3,2}{32} = 0,1(mol)$
$m_{O_2} = 0,1.32 = 3,2(gam)$
$V_{SO_2} = 0,1.22,4 = 2,24(lít)$
Đúng 2
Bình luận (0)
Ta có: n S = 3,2 / 32 = 0,1 ( mol )
PTHH: S + O2 \(\rightarrow\) SO2
0,1--0,1-----0,1
Theo pthh
n O2 = 0,1 ( mol ) => m O2 = 3,2 ( g )
n SO2 = 0,1 ( mol ) => V SO2 = 2,24 ( lít )
Đúng 2
Bình luận (0)
Bài 10: Đốt cháy quặng kẽm sunfua (ZnS), chất này tác dụng với oxi tạo thành kẽm oxit và khí sunfurơ. Nếucho 19,4 gam ZnS tác dụng với 8,96 lít khí oxi (đktc) thì khí sunfurơ có thể tích sinh ra là bao nhiêu?
PT: \(2ZnS+3O_2\underrightarrow{t^o}2ZnO+2SO_2\)
Ta có: \(n_{ZnS}=\dfrac{19,4}{97}=0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{2}< \dfrac{0,4}{3}\), ta được O2 dư.
Theo PT: \(n_{SO_2}=n_{ZnS}=0,2\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,2.22,4=4,48\left(l\right)\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (0)
\(n_{ZnS} = \dfrac{19,4}{97} = 0,2(mol)\\ n_{O_2} = \dfrac{8,96}{22,4} = 0,4(mol)\\ 2ZnS + 3O_2 \xrightarrow{t^o} 2ZnO + 2SO_2\\ \dfrac{n_{Zn}}{2} = 0,1 < \dfrac{n_{O_2}}{3} = 0,133\)
Do đó, oxi dư
\(n_{SO_2} = n_{ZnS} = 0,2(mol)\\ \Rightarrow V_{SO_2} = 0,2.22,4 = 4,48(lít)\)
Đúng 1
Bình luận (0)
Bài 2. Tính số mol của những lượng chất sau:
4 gam khí Hidro, 8 gam CuSO4, 33,6 lit SO2 (ở đktc), 3,6.1023 nguyên tử Na.
Công thức:
Tính số mol khí khi biết thể tích khí ở điều kiện tiêu chuẩn: n = 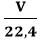
Tính thể tích khí ở điều kiện tiêu chuẩn khi biết số mol: V = n.22,4 (lít)
Trong đó:
+ n: số mol khí (mol)
+ V: thể tích khí ở đktc (lít) công thức
Đúng 0
Bình luận (0)
\(n_{H_2}=\dfrac{4}{2}=2\left(mol\right)\)
\(n_{CuSO_4}=\dfrac{8}{160}=0,05\left(mol\right)\)
\(n_{SO_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\)
\(n_{Na}=\dfrac{3,6.10^{23}}{6.10^{23}}=0,6\left(mol\right)\)
Đúng 0
Bình luận (0)
























