Hỗn hợp X gồm 0,1 mol C2H2; 0,15 mol C2H4; 0,2 mol C2H6 và 0,3 mol H2. Đun nóng X với bột Ni xúc tác, sau một thời gian thu được hỗn hợp Y. Đốt cháy hoàn toàn hỗn hợp Y, thu được khối lượng CO2 là
A. 19,8 gam
B. 29,7 gam
C. 59,4 gam
D. 39,6 gam
Một hỗn hợp X gồm C2H4, C3H6, CH4 và C2H2 trong đó số mol CH4 bằng 2 lần số mol C2H2. Đốt cháy hoàn toàn 0,1 mol hỗn hợp X thu được 9,02 gam CO2 và 3,87 gam H2O. Cho 0,1 mol hỗn hợp X phản ứng tối đa với a gam Br2 trong dung dịch. Giá trị của a là
A. 14,4.
B. 16,0.
C. 17,6.
D. 12,8.
Hỗn hợp X gồm C 2 H 2 , C 2 H 4 và H 2 . Tỷ khối của X đối với H 2 là 7,25. Đốt cháy hoàn toàn 0,1 mol hỗn hợp X thu được 0,1 mol CO 2 . % thể tích của axetilen trong hỗn hợp X?
A. 25%
B. 20%
C. 30%
D. 40%
Hỗn hợp X gồm 0,1 mol C2H2; 0,15 mol C2H4; 0,2 mol C2H6 và 0,3 mol H2. Đun nóng X với bột Ni xúc tác, sau một thời gian thu được hỗn hợp Y. Đốt cháy hoàn toàn hỗn hợp Y, thu được khối lượng CO2 là
A. 19,8 gam
B. 29,7 gam
C. 59,4 gam
D. 39,6 gam
Hỗn hợp X gồm 0,1 mol C2H2; 0,15 mol C2H4; 0,2 mol C2H6 và 0,3 mol H2. Đun nóng X với bột Ni xúc tác 1 thời gian được hỗn hợp Y. Đốt cháy hoàn toàn hỗn hợp Y được số gam CO2 và H2O lần lượt là
A. 39,6 và 23,4
B. 3,96 và 3,35
C. 39,6 và 46,8
D. 39,6 và 11,6
Đốt cháy hỗn hợp X gồm 0,1 mol CH 4 , 0,15 mol C 2 H 2 , 0,2 mol C 2 H 4 và 0,25 mol HCHO cần V lít O 2 (ở đktc). Giá trị của V là :
A. 63,84 lít
B. 34,72 lít
C. 31,92 lít
D. 44,8 lít
Đáp án C
Cách 1 : Tính toán theo phương trình phản ứng:
CH 4 + O 2 → t 0 CO 2 + 2 H 2 O
mol: 0,1 → 0,2
C 2 H 2 + 2 , 5 O 2 → t 0 2 CO 2 + H 2 O
mol: 0,15 → 0,375
C 2 H 4 + 3 O 2 → t 0 2 CO 2 + 2 H 2 O
mol: 0,2 → 0,6
HCHO + O 2 → t 0 CO 2 + 2 H 2 O
mol: 0,25 → 0,25
Từ các phản ứng và giả thiết, ta có :
n O 2 = 1 , 425 mol , V O 2 ( đktc ) = 31 , 92 lít
Cách 2 : Sử dụng bảo toàn electron
Theo bảo toàn electron, ta có :
4 n O 2 ⏟ ? = 8 n CH 4 ⏟ 0 , 1 + 10 n C 2 H 2 ⏟ 0 , 15 + 12 n C 2 H 4 ⏟ 0 , 2 + 4 n H C H O ⏟ 0 , 25
⇒ n O 2 = 1 , 425 mol , V O 2 ( đktc ) = 31 , 92 lít
Cho hỗn hợp khí X gồm: 0,1 mol C2H2, 0,2 mol C2H4, 0,1 mol C2H6 và 0,36 mol H2 qua ống sứ đựng Ni là xúc tác,đun nóng thu được hỗn hợp khí Y. Dẫn hỗn hợp khí Y qua bình đựng brom dư thấy khối lượng của bình tăng 1,64 gam và có hỗn hợp khí Z thoát ra khỏi bình đựng brom. Khối lượng hỗn hợp khí Z bằng bao nhiêu ?
A. 13,26 gam.
B. 10,28 gam.
C. 9,58 gam.
D. 8,20 gam.
Đáp án B
Nhận thấy khối lượng bình brom tăng chính là khối lượng ankin và anken hấp thụ
Bảo toàn khối lượng → mX = mbình tăng + mZ
→ mZ = 0,1.26 + 0,2.28 + 0,1.30 + 0,36.2- 1,64= 10,28 gam
Hỗn hợp khí X gồm 0,1 mol C 2 H 2 ; 0,2 mol C 2 H 4 và 0,3 mol H 2 . Đun nóng X với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y có tỉ khối so với H 2 bằng 11. Hỗn hợp Y phản ứng tối đa với a mol B r 2 trong dung dịch. Giá trị của a là
A. 0,1
B. 0,2
C. 0,4
D. 0,3
Hỗn hợp khí X gồm 0,1 mol C2H2; 0,2 mol C2H4; 0,3 mol H2. Đun nóng X với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 11. Hỗn hợp Y phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
A. 0,3
B. 0,2
C. 0,4
D. 0,1
Áp dụng định luật bảo toàn khối lượng ta có:
mđầu = msau ⇒ nđầu.Mđầu = nsau.Msau
→ n s a u n đ ầ u = M đ ầ u M s a u h a y n 2 n 1 = M 2 M 1
Ta có công thức rất quan trọng là
n đ ầ u - n s a u = n 1 - n 2 = n H 2 p h ả n ứ n g - n π phản ứng
Vậy mục tiêu của ta bây giờ là đi tính n2.
Ta lần lượt có n1 = 0,1 + 0,2 + 0,3 = 0,6 mol.
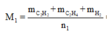
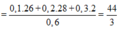
Mà M2 = 11. M H 2 = 11.2 = 22 nên từ:
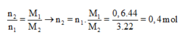
![]()
Phải hiểu rằng n2 = 0,2 mol nghĩa là số mol H2 đã phản ứng là 0,2 mol hay cũng chính là số mol π đã phản ứng là 0,2.
Do đó để tính a là số mol tối đa hỗn hợp Y phản ứng với Br2 trong dung dịch thì ta chỉ cần lấy số mol π ban đầu trừ đi số mol π ban đầu đã phản ứng, hay ta có
a = nπ (đầu) – nπ (đã phản ứng) = 0,1.2 + 0,2.1 –(0,6 – 0,4) = 0,2 mol
Đáp án B
Hỗn hợp khí X gồm 0,1 mol C2H2; 0,2 mol C2H4 và 0,3 mol H2. Đun nóng X với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 11. Hỗn hợp Y phản ứng tối đa với a mol brom trong dung dịch. Giá trị của a là?
A. 0,1
B. 0,3
C. 0,4
D. 0,2
Bài tập này vẫn khá dễ và hơi “kinh điển”
Nhìn chung các bài toán về các phản ứng cộng hidro, tách hidro, crakinh…của hidrocacbon vẫn có cách giải gần tương tự nhau, và ở bài toán này cũng như vậy
![]()
![]()
Xét tỉ lệ quen thuộc:
![]()
Bảo toàn số liêt kết pi ta có: nB =2.04 + 1.0,2-0,2 = 0,2 mol
![]()
![]()
Bài toán số liên kết pi ta có:
![]()
Đáp án D.