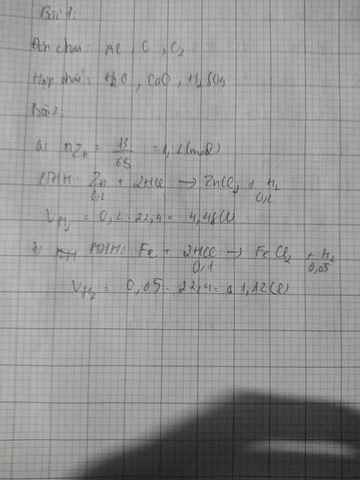Cho 13g kẽm vào 200g dung dịch H2SO4 19,6% tính V h2 ( đktc)

Những câu hỏi liên quan
Cho 13g kẽm (Zn) vào dung dịch axit clohiđric (HCl) lấy dư, sau phản ứng hoàn toàn.
a, Viết PTHH của phản ứng.
b, Tính thể tích khí H2 (đktc) thoát ra?
c, Nếu cho 13g kẽm (Zn) ở trên vào 200g dung dịch HCl 9.125%, sau phản ứng hoàn toàn, tính khối lượng các chất tan trong dung dịch thu được?
Mk đang cần gấp, các bạn giúp mk vs ạ, camon các bn nhiều.
a, Zn + 2HCl ---> ZnCl2 + H2
b, nZn=\(\dfrac{13}{65}=0,2mol\)
Ta có: 1 mol Zn ---> 1 mol H2
nên 0,2 mol Zn ---> 0,2 mol H2
VH2=0,2.22,4=4,48 mol
Đúng 1
Bình luận (0)
Cho 11,2g Fe vào 200g dung dịch H2SO4 19,6%. Biết rằng Fe phản ứng hết
a) Tính khối lượng H2 sinh ra sau phản ứng
b) Tính nồng độ% dung dịch H2SO4 còn lại trong dung dịch sau phản ứng
a) Số mol của 11,2 gam Fe:
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PTHH:
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
1 : 1 : 1 : 1
0,2-> 0,2 : 0,2 : 0,2 (mol)
Khối lượng của 0,2 mol H2:
\(m_{H_2}=n.M=0,2.2=0,4\left(g\right)\)
b) khồi lượng của 0,2 mol H2SO4:
\(m_{H_2SO_4}=n.M=0,2.98=19,6\left(g\right)\)
Nồng độ phần trăm của dd:
\(C\%_{H_2SO_4}=\dfrac{m_{ct}}{m_{dd}}.100\%=\dfrac{19,6}{200}.100\%=9,8\%\)
Đúng 1
Bình luận (0)
Cho 13g kẽm tác dụng với dung dịch axit sunfuric H2SO4thu đuoc muối ZnSO4 và khí H2
A, viết ptpu
B, tính KLM axit H2SO4 pu
C, tính thể tích H2 sinh ra (đktc)
Xem chi tiết
a)
\(Zn + H_2SO_4 \to ZnSO_4 + H_2\)
b)
Theo PTHH : \(n_{H_2SO_4} = n_{H_2} = n_{Zn} = \dfrac{13}{65} = 0,2(mol)\)
\(m_{H_2SO_4} = 0,2.98 = 19,6(gam)\)
c)
\(V_{H_2} = 0,2.22,4 = 4,48(lít)\)
Đúng 3
Bình luận (1)
Cho a g kẽm vào dung dịch có hòa tan 19,6 g H2SO4 loãng, sau khí phản ứng kết thúc. Hãy: a) Viết PTHH. b) Tính a. c) Tính khối lượng muối sinh ra. d) Tính thể tích khí H2 thu được (ở đktc).
\(n_{H_2SO_4}=\dfrac{m}{M}=\dfrac{19,6}{2+32+16\cdot4}=0,2\left(mol\right)\\ PTHH:Zn+H_2SO_4->ZnSO_4+H_2\)
tỉ lệ: 1 : 1 : 1 : 1
n(mol) 0,2<---0,2------>0,2-------->0,2
\(m_{ZnSO_4}=n\cdot M=0,2\cdot\left(65+32+16\cdot4\right)=32,2\left(g\right)\\ V_{H_2\left(dktc\right)}=n\cdot22,4=0,2\cdot22,4=4,48\left(l\right)\)
Đúng 1
Bình luận (0)
Tính thể tích khí H2 ở đktc để điều chế đc khi cho: a) 13g kẽm tác dụng hết vs dung dịch H2SO4 loãng. b ) dung dịch chứa 0.1mol axit HCl tác dụng vs sắt dư
Zn+2H2SO4->ZnSO4+H2
0,2----------------------------0,2
n Zn=\(\dfrac{13}{65}\)=0,2 mol
=>VH2=0,2.22,4=4,48l
b)
Fe+2HCl->FeCl2+H2
0,1--------------0,05 mol
=>VH2=0,05.22,4=1,12l
Đúng 1
Bình luận (0)
\(a,n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\ Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ n_{H_2}=n_{Zn}=0,2\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\\ b,Fe+2HCl\rightarrow FeCl_2+H_2\\ n_{HCl}=0,1\left(mol\right)\Rightarrow n_{H_2}=\dfrac{0,1}{2}=0,05\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,05.22,4=1,12\left(l\right)\)
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 13g kẽm vào dung dịch axit axetic 0.6M A)Viết pthh B) Tính thể tích H2 ở ĐKTC C)TÍNH V dd axit đã dùng
\(a) Zn + 2CH_3COOH \to (CH_3COO)_2Zn + H_2\\ b) n_{H_2} = n_{Zn} =\dfrac{13}{65} = 0,2(mol)\\ V_{H_2} = 0,2.22,4 = 4,48(lít)\\ c) n_{CH_3COOH} = 2n_{Zn} = 0,4(mol)\\ V_{dd\ CH_3COOH} = \dfrac{0,4}{0,6} = 0,667(lít)\)
Đúng 1
Bình luận (0)
https://hoc24.vn/cau-hoi/hoa-tan-hoan-toan-13g-kem-vao-dung-dich-axit-axetic-06maviet-pthhb-tinh-the-tich-h2-o-dktcctinh-v-dd-axit-da-dung.744066954945
Đúng 0
Bình luận (0)
cho 16g Fe2O3 vào 200g dung dịch H2SO4 19,6%. Tính khối lượng muối?
Số mol sắt (III) oxit
nFe2O3 = \(\dfrac{m_{Fe2O3}}{M_{Fe2O3}}=\dfrac{16}{160}=0,1\left(mol\right)\)
Khối lượng của axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{19,6.200}{100}=39,2\left(g\right)\)
Số mol của axit sunfuric
nH2SO4= \(\dfrac{m_{H2SO4}}{M_{H2SO4}}=\dfrac{39,2}{98}=0,4\left(mol\right)\)
Pt : Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O\(|\)
1 3 1 3
0,1 0,4 0,1
Lập tỉ số so sánh : \(\dfrac{0,1}{1}< \dfrac{0,4}{3}\)
⇒ Fe2O3 phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol Fe2O3
Số mol của muối sắt (III) sunfat
nFe2(SO4)3 = \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
Khối lượng của muối sắt (III) sunfat
mFe2(SO4)3 = nFe2(SO4)3 . MFe2(SO4)3
= 0,1 . 400
= 40 (g)
Chúc bạn học tốt
Đúng 4
Bình luận (0)
Cho 6.5 gam kẽm vào 200g dung dịch axit clohidric(HCl) thu được kẽm clorua(ZnCl2) và khí Hidro(H2)
a. TÍnh thể tích khí hidro(H2) thu được (ở đktc)
b Tính nồng độ phần trăm của dung dịch axit clohidric HCl đã dùng
Biết (H=1 ; Zn=65 ; Cl=35.5)
`Zn + 2HCl -> ZnCl_2 + H_2`
`0,1` `0,2` `0,1` `(mol)`
`n_[Zn]=[6,5]/65=0,1(mol)`
`a)V_[H_2]=0,1.22,4=2,24(l)`
`b)C%_[HCl]=[0,2.36,5]/200 . 100 =3,65%`
Đúng 4
Bình luận (3)
`Zn + HCl -> ZnCl_2 + H_2` `\uparrow`
`n_(Zn) = (6,5)/65 = 0,1 mol`.
`n_(H_2) = 0,1 mol`.
`V(H_2) = 0,1 xx 22,4 = 2,24l`.
`C%(HCl) = (0,2.36,5)/200 xx 100 = 36,5%`.
Đúng 3
Bình luận (2)
Cho 13g kẽm vào dung dịch chứa 0,5mol dung dịch axit clohidric:
a)Tính thể tích khí H2 (ở đktc) thu được.
b)Chất còn dư sau phản ứng là chất nào? Dư bao nhiêu?
GIÚP MÌNH VỚI MAI ĐI HỌC RÙI :((
a) \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,5}{2}\) => Zn hết, HCl dư
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,2--->0,4-------------->0,2
=> \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b) \(n_{HCl\left(dư\right)}=0,5-0,4=0,1\left(mol\right)\)
=> \(m_{HCl\left(dư\right)}=0,1.36,5=3,65\left(g\right)\)
Đúng 3
Bình luận (0)