Hoà tan 74,2 gam hỗn hợp 2 tinh thể gồm MgSO4.7H2O và CuSO4.5H2O vào H2O thu được ddA có C% CuSO4 là 3,2% và C% MgSO4 là 4,8%. Tính C% theo khối lượng của các tinh thể ban đầu.
Mình cần gấp!!
Hòa tan m gam tinh thể CuSO4.5H2O vào V ml dung dịch CuSO4 có nồng độ c% (khối lượng riêng bằng d g/ml) thu được dung dịch X. Tính nồng độ % của dung dịch X theo m, V, c và d.
Khối lượng CuSO4 có trong m gam tinh thể : \(\frac{160}{250}\)m = 0,64(g)
Khối lượng CuSO4 trong V ml dung dịch CuSO4 c% ((khối lượng riêng bằng d g/ml) là : \(\frac{V.d.c}{100}\) = 0,01 V.d.c (g)
Khối lượng dung dịch X bằngv : m+V.d (g)
Nồng độ phần trăm của dung dịch X:
\(\frac{0,64m+0,01V.d.c}{m+V.d}.100\%=\frac{64m+V.d.c}{m+V.d}\left(\%\right)\)
Câu 1: Tính khối lượng muối NaNO3 cần lấy để khi hòa tan vào 170 g nước thì thu được dung dịch có nồng độ 15 %
Câu 2: Hòa tan 75 g tinh thể CuSO4.5H2O vào trong nước thu được 900 ml dd CuSO4. Tính CM dd này
Câu 3: Khối lượng riêng dd CuSO4 là 1,206 g/ml. Đem cô cạn 414,594 ml dd này thu được 140,625 g tinh thể CuSO4.5H2O . Tính nồng độ mol và nồng độ % dd nói trên.
Câu 1 :
Khối lượng dung dịch là : \(m_{ct}+170\)
Gọi khối lượng muối \(NaNO_3\)cần dùng là x
Ta có :\(m_{ct}=\frac{C\%.m_{dd}}{100}\)
hay \(x=\frac{15.\left(x+170\right)}{100}\)
Ta tính được x=30 (g)
Vậy khối lượng \(NaNO_3\)cần lấy là 30 g
Câu 2 :
Số mol \(CuSO_4.5H_2O\)là :
\(n_{CuSO_4.5H_2O}=\frac{m}{M}=\frac{75}{250}=0,3\left(mol\right)\)
\(\Rightarrow n_{CuSO_4}=0,3\left(mol\right);V_{dd}=900ml=0,9l\)
\(C_{M_{dd}}=\frac{n}{V}=\frac{0,3}{0,9}=\frac{1}{3}M\)
Vậy...
Tính khối lượng tinh thể CuSO4.5H2O cần dùng hòa tan hoàn toàn vào 400 gam dung dịch CuSO4 2% để thu được dung dịch CuSO4 1M ( D = 1,1 g/ml).
Gọi số mol CuSO4.5H2O cần lấy là x (mol) => nCuSO4 = x (mol)
Khối lượng CuSO4 2% có trong 400 gam dung dịch là:
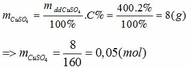
Tổng số mol CuSO4 sau khi hòa tan là: x + 0,05 (mol)
=> thể tích dung dịch sau khi hòa tan:

Từ (1) và (2)
=> (x+ 0,05).1000
=> 1100x + 55 = 160x + 400
=> 850x = 345
=> x ≈0, 406 (mol)
=> mCuSO4.5H2O = 0,406.250 = 101,47 (g)
Hòa tan hoàn toàn 35,5g CuSO4 vào 152,25g H2O thu được dd X. Làm lạnh dd X xuống còn 20oC thấy có m gam tinh thể CuSO4.5H2O. Biết độ tan của CuSO4 ở 20oC là 20,7g. Tính giá trị của m
mCuSO4 trong tinh thể = \(\dfrac{160m}{250}\)= 0,64m
=> mH2O trong tinh thể = 0,36m
mH2O còn sau khi tách tinh thể = 152,25 - 0,36m
m CuSO4 trong dd bảo hoà = 35,5 - 0,64m = 0,207.(152,25 - 0,36m)
=> m =7,05(g)
Hoà tan hết hỗn hợp kim loại gồm 4,8 gam Magie và 2,7 gam nhôm bằng dung dịch axit sunfuric nồng độ 20% vừa đủ.
a) Viết các PTHH của phản ứng xảy ra.
b) Tính thể tích khí thu được (ở đktc).
c) Tính khối lượng mỗi muối thu được.
d) Xác định khối lượng dung dịch axit cần dùng.
e) Tính nồng độ phần trăm của dung dịch muối tạo thành.
a) \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
b) \(n_{H_2\left(1\right)}=n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
\(n_{H_2\left(2\right)}=\dfrac{3}{2}n_{Al}=\dfrac{3}{2}.\dfrac{2,7}{27}=0,15\left(mol\right)\)
=> \(V=\left(0,2+0,15\right).22,4=7,84\left(l\right)\)
c) \(n_{H_2SO_4\left(1\right)}=n_{Mg}=0,2\left(mol\right)\)
\(n_{H_2SO_4\left(2\right)}=\dfrac{3}{2}n_{Al}=0,15\left(mol\right)\)
=> \(m_{ddH_2SO_4}=\dfrac{0,35.98}{20\%}=171,5\left(g\right)\)
d) \(m_{ddsaupu}=4,8+2,7+171,5-0,35.2=178,3\left(g\right)\)
\(C\%_{MgSO_4}=\dfrac{120.0,1}{178,3}.100=6,73\%\)
\(C\%_{Al_2\left(SO_4\right)_3}=\dfrac{342.0,05}{178,3}.100=9,59\%\)
a,Mg+H2SO4-> MgSO4 +H2
2Al +3H2SO4 -> Al2(SO4)3 +3H2
b, n(Mg)=0,2mol
n(Al)=0,1mol
Số mol H2SO4=số mol H2= 0,2+ 0,1*3/2 =0,35mol
V(H2)= 7,84lit
c, MgSO4: m=0,2*120=24(g)
Al2(SO4)3 : m=342*0,05= 17,1(g)
d, khối lượng H2SO4= 0,35*98=34,3(g)
Khối lượng dd H2SO4 là:
m(dd)=34,3*100/20 = 171,5(g)
e,khối lượng dd sau pứ
m= m(Mg) +m(Al) + m(dd H2SO4) -m(H2) = 4,8+2,7+171,5-0,35*2=178,3(g)
C%(MgSO4)= 24*100%/178,3 =13,46%
C%(Al2SO4)3 = 17,1*100%/178,3 =9,59%
Độ tan của CuSO4 ở 85°C và 12°C lần lượt là 87.7 gam và 35.5 gam. Khi làm lạnh 1877 gam dung dịch bão hoà CuSO4 từ 80°C -> 12°C thì có bao nhiêu gam tinh thể CuSO4.5H2O tách ra khỏi dung dịch
Ở 85oC, S = 87,7 gam tức là
87,7 gam CuSO4 tan tối đa trong 100 gam nước tạo 187,7 gam dd bão hòa
Vậy : x gam CuSO4 tan tối đa trong y gam nước tạo thành 1877 gam dd bão hòa
Suy ra:
$x = (1877.87,7) : 187,7 = 877(gam)$
$y = (1877.100) : 187,7 = 1000(gam)$
Gọi $n_{CuSO_4.5H_2O} = a(mol)$
Sau khi tách tinh thể :
$m_{CuSO_4} = 877 - 160a(gam)$
$m_{H_2O} = 1000 - 18.5a = 1000 - 90a(gam)$
Ta có :
$S = \dfrac{877 -160a}{1000 - 90a} .100 = 35,5$
$\Rightarrow a = 4,1$
$m_{CuSO_4.5H_2O} = 4,1.250 = 1025(gam)$
Mình biết nội quy nhưng mình đang bí muốn nhờ mấy thánh hóa giải hộ
Hòa tan 99,8 gam cuso4.5h2o vào 164 ml nước .làm lạnh dung dịch tới 10 độ C thu được 30 gam tinh thể cuso4.5h2o.biết độ tan của cuso4 kan ở 10 độ C là 17,4 gam .hãy xét xem cuso4 có lẫn tạp chất hay không . nếu có lẫn thì khối lượng của tạp chất là bao nhiêu ?
cái thằng điên này người ta mới học lớp 3 đố cái gì mà đố.
Một tinh thể CuSO4.nH2O có hàm lượng nước kết tinh là 36%. Hoà tan x gam CuSO4.nH2O vào y gam nước thu được 150g dd A nồng độ 8% a-Tính giá trị n, x và y . b-Nếu thêm vào ddA trên 50g tinh thể trên nữa thi được ddB nồng độ mấy %
Hòa tan 99,8 gam CuSO4.5H2O vào 164 ml nước, làm lạnh dung dịch tới 10℃ thu
được 30 gam tinh thể CuSO4.5H2O. Cho biết độ tan của CuSO4 khan ở 10℃ là 17,4 gam.
Xác định xem CuSO4.5H2O có lẫn tạp chất hay tinh khiết. Tính khối lượng tạp chất (nếu có).
mH2O(bđ) = 164 (g)
mdd ở 10oC = 99,8 + 164 - 30 = 233,8 (g)
Giả sử có 100 gam dd CuSO4 bão hòa ở 10oC
\(S_{10^oC}=\dfrac{m_{CuSO_4}}{100-m_{CuSO_4}}.100=17,4\left(g\right)\)
=> mCuSO4 = \(\dfrac{8700}{587}\left(g\right)\)
=> \(C\%_{dd.CuSO_4.bão.hòa.ở.10^oC}=\dfrac{\dfrac{8700}{587}}{100}.100\%=\dfrac{8700}{587}\%\)
Vậy, trong dd CuSO4 ở 10oC chứa
\(m_{CuSO_4}=\dfrac{233,8.\dfrac{8700}{587}}{100}=34,652\left(g\right)\)
Bảo toàn CuSO4: \(n_{CuSO_4.5H_2O\left(bd\right)}=\dfrac{34,652}{160}+\dfrac{30}{250}=0,336575\left(mol\right)\)
=> \(m_{CuSO_4.5H_2O\left(bđ\right)}=0,336575.250=\dfrac{13463}{160}\left(g\right)< 99,8\left(g\right)\)
=> CuSO4.5H2O ban đầu có tạp chất
mtạp chất = \(99,8-\dfrac{13463}{160}=15,65625\left(g\right)\)