cho 11,1 g hỗn hợp 3 kim loại natri,canxi và kim loại m có hoá trị 2 có tỉ lệ số mol tương ứng 1;1;2 .tác dụng với oxi dư thu được 16,7 g hỗn hợp baoxit tìm kim loại m

Những câu hỏi liên quan
cho 6,54 g hỗn hợp Zn và kim loại m hóa trị 2 có tỉ lệ mol tương ứng là 1:1 tác dụng với Oxy dư thu được 8,05 gam hỗn hợp 2 oxit xác định kim loại m
Xem chi tiết
\(n_{Zn}=n_M=a\left(mol\right)\)
\(\Rightarrow65a+Ma=6.54\\ \\ \Rightarrow a\left(65+M\right)=6.54\)
\(2Zn+O_2\rightarrow2ZnO\)
\(2M+O_2\rightarrow2MO\)
\(m_{oxit}=81a+\left(M+16\right)a=8.05\left(g\right)\)
\(\Rightarrow\left(65+M\right)a+32a=8.05\)
\(\Rightarrow6.54+32a=8.05\)
\(\Rightarrow a=\dfrac{151}{3200}\)
\(\left(1\right)\Rightarrow M=\dfrac{6.54}{\dfrac{151}{3200}}-65=73.5\)
Em xem lại đề nhé !!
Đúng 2
Bình luận (0)
Cho 11,1 g hỗn hợp X gồm kim loại M và nhôm có tỉ lệ mol 3:2 vào dd HCl dư, sinh ra 6,72 lít H2 đktc. Xác định kim loại M
Gọi số mol M, Al là a, b
=> a.MM + 27b = 11,1 (1)
Và \(\dfrac{a}{b}=\dfrac{3}{2}\) (2)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
- Nếu M không tác dụng với HCl
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,2<-----------------------0,3
=> \(\left\{{}\begin{matrix}n_X=0,3\left(mol\right)\\m_X=11,1-0,2.27=5,7\left(g\right)\end{matrix}\right.\)
=> \(M_M=\dfrac{5,7}{0,3}=19\left(Loại\right)\)
=> M tác dụng được với HCl
PTHH: 2M + 2nHCl --> 2MCln + nH2
a-------------------------->0,5an
2Al + 6HCl --> 2AlCl3 + 3H2
b-------------------------->1,5b
=> 0,5an + 1,5b = 0,3 (3)
(1)(2)(3) => MM = 18,5.n + 19
Xét n = 1 => MM = 37,5 (Loại)
Xét n = 2 => MM = 56(g/mol) => M là Fe
Xét n = 3 => MM = 74,5(Loại)
Đúng 3
Bình luận (1)
Cho ba kim loại X Y Z có khối lượng nguyên tử theo tỉ lệ 3 : 3,375 : 7 . Tỉ lệ với số mol tương ứng 3 kim loại trên trong hỗn hợp là 1 : 2 : 3 ( hỗn hợp a ) . Khi cho một lượng kim loại X bằng lượng của nó có trong 24,6 g hỗn hợp A tác dụng với dung dịch HCl dư thu được 2,24 lít khí h2 ( đktc ) xác định các kim loại X Y Z
Đặt \(\left\{{}\begin{matrix}M_X=3a\left(g/mol\right)\\M_Y=3,375a\left(g/mol\right)\\M_Z=7a\left(g/mol\right)\end{matrix}\right.\) và \(\left\{{}\begin{matrix}n_X=x\left(mol\right)\\n_Y=2x\left(mol\right)\\n_Z=3x\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_X=3ax\left(g\right)\\m_Y=3,375a.3x=6,75ax\left(g\right)\\m_Z=7a.3x=21ax\left(g\right)\end{matrix}\right.\)
\(\Rightarrow3ax+6,75ax+21ax=24,6\Leftrightarrow ax=0,8\)
\(\Rightarrow m_X=3.0,8=2,4\left(g\right)\)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Gọi hóa trị của X là n (n nguyên dương)
PTHH: \(2X+2nHCl\rightarrow2XCl_n+nH_2\)
\(\dfrac{0,2}{n}\)<--------------------------0,1
\(\Rightarrow M_X=\dfrac{2,4}{\dfrac{0,2}{n}}=12n\left(g/mol\right)\)
Xét n = 2 thỏa mãn \(\Rightarrow M_X=12.2=24\left(g/mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}M_Y=\dfrac{3,375}{3}.M_X=27\left(g/mol\right)\\M_Z=\dfrac{7}{3}.M_X=56\left(g/mol\right)\end{matrix}\right.\)
Vậy ba kim loại X, Y, Z lần lượt là magie (Mg), nhôm (Al), sắt (Fe)
Đúng 1
Bình luận (0)
Cho hỗn hợp A gồm Canxi và kim loại M (hoá trị không đổi) có tỉ lệ mol 3:2. Cho 8,7 (g) A vào bình chứa 2,24 lít khí Cl2 (ở đktc). Sau phản ứng xảy ra hoàn toàn thu được hỗn hợp rắn B. Hoà tan hoàn toàn B trong dung dịch HCl dư sinh ra 4,48 lít khí (đktc). Xác định M.
M = 2:3 = 0,5
Cl2 nguyên tử khối = 35,5-0,5=35 (cho sự hoà tan)
B = HCL - 4,48
HCL = hiđrô + clo
Nhưng clo bằng CL2 (nguyên tử khối)
M bằng 35,5 (Clo)
Đúng 0
Bình luận (0)
\(Ca\left(y\right)+Cl_2\left(y\right)\rightarrow CaCl_2\)
\(2M\left(\frac{2z}{a}\right)+aCl_2\left(z\right)\rightarrow2MCl_a\)
\(Ca\left(1,5x-y\right)+HCl\rightarrow CaCl_2+H_2\left(1,5x-y\right)\)
\(2M\left(x-\frac{2z}{a}\right)+2aHCl\rightarrow2MCl_a+aH_2\left(\frac{ax-2z}{2}\right)\)
Gọi số mol và hóa trị của M lần lược là x, a thì số mol Ca là 1,5x. Ta có:
\(Mx+60x=8,7\left(1\right)\)
Vì khi cho vào HCl thì còn có khí bay ra nên Cl2 phản ứng hết còn kim loại dư
Gọi số mol Cl2 phản ứng với Ca, M lần lược là y, z
\(n_{Cl_2}=\frac{2,24}{22,4}=0,1\)
\(\Rightarrow y+z=0,1\left(2\right)\)
\(n_{Ca\left(dư\right)}=1,5x-y\)
\(n_{M\left(dư\right)}=x-\frac{2z}{a}\)
\(n_{H_2}=\frac{4,48}{22,4}=0,2\)
\(\Rightarrow1,5x-y+\frac{ax-2z}{2}=0,2\)
\(\Rightarrow3x-2y+ax-2z=0,4\left(3\right)\)
Từ (1), (2), (3) ta có hệ: \(\left\{\begin{matrix}Mx+60x=8,7\\y+z=0,1\\3x-2y+ax-2z=0,4\end{matrix}\right.\)
\(\Leftrightarrow\left\{\begin{matrix}Mx+60x=8,7\\y+z=0,1\\3x+ax=0,6\end{matrix}\right.\)
\(\Leftrightarrow\left\{\begin{matrix}M.\left(\frac{0,6}{3+a}\right)+60.\left(\frac{0,6}{3+a}\right)=8,7\\y+z=0,1\\x=\frac{0,6}{3+a}\end{matrix}\right.\)
\(\Rightarrow87a-6M=99\)
\(\Leftrightarrow M=\frac{29a-33}{2}\)
Thế a lầ lược bằng 1, 2, 3, ... ta nhận a = 3, M = 27
Vậy M là Al
Đúng 0
Bình luận (0)
Sao bạn tiến quang có mỗi cái hình doraemon mà cũng được cộng đồng lựa chọn?![]()
Đúng 0
Bình luận (6)
Xem thêm câu trả lời
Cho 1,16 (g) hỗn hợp gồm 3 kim loại X, Y, Z (đều có hoá trị II) hoà tan hết trong dung dịch HCl dư thì thấy có 0,748 lít khí thoát ra. Tỉ lệ nguyên tử khối của X:Y:Z là 3:5:7 và tỉ lệ số mol của X:Y:Z trong hỗn hợp là 4:2:1. Xác định 3 kim loại X, Y, Z
Biết sơ đồ phản ứng của Y là: Y + HCl --> YCl2 + H2
\(n_X=4x\left(mol\right),n_Y=2x\left(mol\right),n_Z=x\left(mol\right)\)
\(M_X=3M\left(\dfrac{g}{mol}\right),M_Y=5M\left(\dfrac{g}{mol}\right),M_Z=7M\left(\dfrac{g}{mol}\right)\)
\(m_{hh}=4x\cdot3M+2x\cdot5M+x\cdot7M=1.16\left(g\right)\)
\(\Rightarrow Mx=0.04\left(1\right)\)
\(n_{H_2}=\dfrac{0.784}{22.4}=0.035\left(mol\right)\)
\(X+2HCl\rightarrow XCl_2+H_2\)
\(Y+2HCl\rightarrow YCl_2+H_2\)
\(Z+2HCl\rightarrow ZCl_2+H_2\)
\(\Rightarrow4x+2x+x=0.035\)
\(\Rightarrow x=0.005\)
\(Từ\left(1\right):\Rightarrow M=\dfrac{0.04}{0.005}=8\)
\(M_X=8\cdot3=24\left(\dfrac{g}{mol}\right)\)
\(M_Y=8\cdot5=40\left(\dfrac{g}{mol}\right)\)
\(M_Z=8\cdot7=56\left(\dfrac{g}{mol}\right)\)
\(X:Mg,Y:Ca,Z:Fe\)
Đúng 1
Bình luận (3)
Cho 11,1 gam hỗn hợp X gồm kim loại M và Al có tỉ lệ mol tương ứng 3:2 vào dung dịch HCl dư, sinh ra 6,72 lít H2 ở đktc. Xác định kim loại M.
gọi số mol M là X số mol Al là Y ta có X/Y=3/2
X=3/2 Y (1)
mà X * klrM + Y * 27 = 11,1 (2) thế (1) và (2) ta rút hệ Y = 11,1/3/2*klrM + 27 (3)
phương trình
2M + 2nHCl --> 2MCln + nH2
X n/2 X
2Al + HCl --> 2AlCl3 + 3H2
Y 3/2Y
theo đề bài ta có n/2X + 3/2 Y = 0,3(4) (mol hidro)
thay (1) vào (4) ta rút Y = 0,3/3/2 +3n/4 (5)
từ (3) và (5) ta có bảng nghiệm thế hóa trị ta có nghiệm thỏa mản n bằng 2 klr M = 56 vậy M là Fe
Đúng 0
Bình luận (0)
Câu 5: Cho 33,6 gam hỗn hợp A gồm 2 kim loại Mg và X (chưa biết) có tỉ lệ số mol tương ứng là 2 : 3. Khối lượng Mg bằng khối lượng Mg có trong 16 gam MgO.a/ Tính khối lượng Mg trong hỗn hợp A.b/ Tính số mol X có trong hỗn hợp A, từ đó tìm kim loại X.c/ Đốt cháy hoàn toàn 33,6 gam hỗn hợp A trong không khí, thu được 49,6 gam hỗn hợp sản phẩm.- Viết PTHH.- Tính khối lượng khí oxi cần dùng cho phản ứng.- Tính thể tích không khí (đktc) cần dùng biết O2 chiếm 20% thể tích không khí.
Đọc tiếp
Câu 5: Cho 33,6 gam hỗn hợp A gồm 2 kim loại Mg và X (chưa biết) có tỉ lệ số mol tương ứng là 2 : 3. Khối lượng Mg bằng khối lượng Mg có trong 16 gam MgO.
a/ Tính khối lượng Mg trong hỗn hợp A.
b/ Tính số mol X có trong hỗn hợp A, từ đó tìm kim loại X.
c/ Đốt cháy hoàn toàn 33,6 gam hỗn hợp A trong không khí, thu được 49,6 gam hỗn hợp sản phẩm.
- Viết PTHH.
- Tính khối lượng khí oxi cần dùng cho phản ứng.
- Tính thể tích không khí (đktc) cần dùng biết O2 chiếm 20% thể tích không khí.
a) \(n_{MgO}=\dfrac{16}{40}=0,4\left(mol\right)\)
=> nMg = 0,4 (mol)
=> mMg = 0,4.24 = 9,6 (g)
b) nMg = 0,4 (mol) => nX = 0,6 (mol)
mX = 33,6 - 9,6 = 24 (g)
=> \(M_X=\dfrac{24}{0,6}=40\left(g/mol\right)\)
=> X là Ca
c)
PTHH: 2Mg + O2 --to--> 2MgO
2Ca + O2 --to--> 2CaO
\(m_{O_2}=49,6-33,6=16\left(g\right)\)
=> \(n_{O_2}=\dfrac{16}{32}=0,5\left(mol\right)\)
=> VO2 = 0,5.22,4 = 11,2 (l)
=> Vkk = 11,2.5 = 56 (l)
Đúng 4
Bình luận (1)
a)\(n_{MgO}=\dfrac{16}{40}=0,4mol\Rightarrow n_{Mg}=0,4mol\Rightarrow m_{Mg}=9,6g\)
\(\Rightarrow m_X=33,6-9,6=24g\)
b)Theo bài: \(\dfrac{n_{Mg}}{n_X}=\dfrac{2}{3}\Rightarrow\dfrac{0,4}{n_X}=\dfrac{2}{3}\Rightarrow n_X=0,6mol\)
\(\Rightarrow M_X=\dfrac{24}{0,6}=40\Rightarrow X:Ca\)
c)\(2Mg+O_2\underrightarrow{t^o}2MgO\)
\(x\) \(x\)
\(2Ca+O_2\underrightarrow{t^o}2CaO\)
\(y\) \(y\)
\(\Rightarrow\left\{{}\begin{matrix}24x+40y=33,6\\40x+56y=49,6\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,4\\y=0,6\end{matrix}\right.\)
\(\Sigma n_{O_2}=\dfrac{1}{2}n_{Mg}+\dfrac{1}{2}n_{Ca}=0,2+0,3=0,5mol\)
\(m_{O_2}=0,5\cdot32=16g\)
\(V_{kk}=5V_{O_2}=5\cdot0,5\cdot22,4=56l\)
Đúng 1
Bình luận (0)
Cho 19 gam hỗn hợp gồm kim loại M ( hóa trị không đổi ) và Zn (có tỉ lệ mol tương ứng là 1,25:1) và bình đựng 4,48 lít khí Cl2 (đktc), sau các phản ứng hoàn toàn thu được hỗn hợp chất rắn X. Cho X tan hết trong dung dịch HCl (dư) thấy có 5,6 lít khí H2 thoát ra (đktc). Kim loại M là A. Mg B. Al C. Ca D. Na
Đọc tiếp
Cho 19 gam hỗn hợp gồm kim loại M ( hóa trị không đổi ) và Zn (có tỉ lệ mol tương ứng là 1,25:1) và bình đựng 4,48 lít khí Cl2 (đktc), sau các phản ứng hoàn toàn thu được hỗn hợp chất rắn X. Cho X tan hết trong dung dịch HCl (dư) thấy có 5,6 lít khí H2 thoát ra (đktc). Kim loại M là
A. Mg
B. Al
C. Ca
D. Na
Đáp án A
M → Mn+ + ne
1,25 → 1,25nx
Zn → Zn2+ + 2e
x → 2x
Cl2 + 2e → 2Cl-
0,2 → 0,4
2H+ + 2e → H2
0,5 ← 0,25
BT e ⇒1,25nx + 2x = 0,4 + 0,5 = 0,9 (1)
Mặt khác: 1,25M + 65M = 19 (2)
(1)(2) ⇒ (1,25M +65)/(1,25n + 2) = 19/0,9 ⇒ n = 2; M = 24(Mg)
Đúng 0
Bình luận (0)
Cho 19 gam hỗn hợp gồm kim loại M ( hóa trị không đổi ) và Zn (có tỉ lệ mol tương ứng là 1,25:1) và bình đựng 4,48 lít khí Cl2 (đktc), sau các phản ứng hoàn toàn thu được hỗn hợp chất rắn X. Cho X tan hết trong dung dịch HCl (dư) thấy có 5,6 lít khí H2 thoát ra (đktc). Kim loại M là: A. Mg B. Al C. K D. Na
Đọc tiếp
Cho 19 gam hỗn hợp gồm kim loại M ( hóa trị không đổi ) và Zn (có tỉ lệ mol tương ứng là 1,25:1) và bình đựng 4,48 lít khí Cl2 (đktc), sau các phản ứng hoàn toàn thu được hỗn hợp chất rắn X. Cho X tan hết trong dung dịch HCl (dư) thấy có 5,6 lít khí H2 thoát ra (đktc). Kim loại M là:
A. Mg
B. Al
C. K
D. Na
Đáp án A
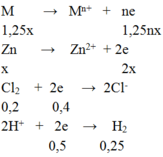
Bảo toàn e ⇒1,25nx + 2x = 0,4 + 0,5 = 0,9 (1)
Mặt khác: 1,25M + 65M = 19 (2)
Từ (1) và (2) ⇒ (1,25M +65M)/(1,25n + 2) = 19/0,9 ⇒ n = 2; M = 24(Mg)
Đúng 0
Bình luận (0)























