0,80g một kim loại II hòa tan hoàn toàn trong 100ml H2SO4 0,50M. Lượng axit còn dư phản ứng vừa đủ với 33,4ml dung dịch NaOH 1,00M. Xác định tên kim loại

Những câu hỏi liên quan
Hòa tan hoàn toàn 0,8 g một kim loại hoá trị II hoà tan hoàn toàn trong 100 ml H 2 S O 4 0,5 M. Lượng axit còn dư phản ứng vừa đủ với 33,4 ml dung dịch NaOH 1,00 M. Xác định tên kim loại.
Số mol H 2 S O 4 trong 100ml dung dịch 0,5M là :
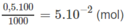
Số mol NaOH trong 33,4 ml nồng độ 1M :
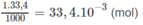
H 2 S O 4 + 2NaOH → N a 2 S O 4 + 2 H 2 O
Lượng H 2 S O 4 đã phản ứng với NaOH :

Số mol H 2 S O 4 đã phản ứng với kim loại là :
5. 10 - 2 - 1.67. 10 - 2 = 3,33. 10 - 2 mol
Dung dịch H 2 S O 4 0,5M là dung dịch loãng nên :
X + H 2 S O 4 → X S O 4 + H 2 ↑
Số mol X và số mol H 2 S O 4 phản ứng bằng nhau, nên :
3,33. 10 - 2 mol X có khối lượng 0,8 g
1 mol X có khối lượng: 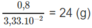
⇒ Mkim loại = 24 g/mol.
Vậy kim loại hoá trị II là magie.
Đúng 0
Bình luận (0)
hòa tan hoàn toàn một kim loại kiềm thổ R vào 200ml dung dịch HCl 2M.Để trung hòa lượng axit dư cần 100ml dung dịch NaOH 3M xác định tên kim loại đó.....trân thành cẳm ơn
Đề thiếu m
NaOH + HCl = NaCl + H2O
0,3 - - - - 0,3
=>số mol HCl pư là 0,1 mol
=>số mol OH- = số mol H+ = số mol HCl = 0,1 mol
=>số mol kiềm thổ là 0,05 mol
=>R = 6,85 / 0,05 = 137 => Ba
Đúng 0
Bình luận (0)
hòa tan hoàn toàn một kim loại kiềm thổ R vào 200ml dung dịch HCl 2M.Để trung hòa lượng axit dư cần 100ml dung dịch NaOH 3M xác định tên kim loại đó.....trân thành cẳm ơn
<a href="http://tchiase.info/office-2016-tai-office-2016-professional-plus-full-crack/">tải office 2016</a>
Đúng 0
Bình luận (0)
Hòa tan 1,3g một kim loại R trong 100ml dung dịch H2SO4 0,3M. Để trung hòa lượng axit dư cần 200ml dung dịch NaOH 0,1M. Xác định kim loại R?
\(n_{NaOH} =0,2.0,1 = 0,02(mol)\\ 2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O\\ n_{H_2SO_4\ dư} = \dfrac{1}{2}n_{NaOH} = 0,01(mol)\\ \Rightarrow n_{H_2SO_4\ pư} = 0,1.0,3 - 0,01 = 0,02(mol)\)
Gọi n là hóa trị của kim loại R
\(2R + nH_2SO_4\to R_2(SO_4)_3 + nH_2\\ n_R = \dfrac{2}{n}n_{H_2SO_4} = \dfrac{0,04}{n}(mol)\\ \Rightarrow \dfrac{0,04}{n}.R = 1,3\\ \Rightarrow R = \dfrac{65}{2}n\)
Với n = 2 thì R = 65(Zn)
Đúng 1
Bình luận (1)
Cho 1,44g một kim loại R có hoá trị II phản ứng hoàn toàn trong 250ml dung dịch H2SO4 0,3M. Dung dịch thu được còn chứa axit dư và phải trung hoà axit dư bằng 60ml dung dịch NaOH 0,5M. Hãy xác định kim loại R
\(n_{NaOH}=0.06\cdot0.5=0.03\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=\dfrac{0.03}{2}=0.015\left(mol\right)\)
\(n_{H_2SO_4\left(pư\right)}=0.25\cdot0.3-0.015=0.06\left(mol\right)\)
\(R+H_2SO_4\rightarrow RSO_4+H_2\)
\(0.06....0.06\)
\(M_R=\dfrac{1.44}{0.06}=24\left(\dfrac{g}{mol}\right)\)
\(R:Mg\)
Đúng 3
Bình luận (0)
n NaOH = 0,06.0,5 = 0,03(mol)
$2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
n H2SO4 dư = 1/2 n NaOH = 0,015(mol)
n H2SO4 pư = 0,25.0,3 - 0,015 = 0,06(mol)
$R + H_2SO_4 \to RSO_4 + H_2$
n R = n H2SO4 pư = 0,06(mol)
M R = 1,44/0,06 = 24(Mg)
Vậy R là Magie
Đúng 3
Bình luận (0)
Hòa tan hoàn toàn 1,52g hỗn hợp gồm 2 kim loại là Fe và R(có hóa trị II) trong dd HCl 15% vừa đủ, thu được 672ml khí (đktc) và dd B. Nếu hòa tan 1,52g kim loại R trong 49gam dd H2SO4 8% thì lượng axit còn dư. a,Xác định tên kim loại R b,Tính thành phần % về khối lượng mỗi kim loại trong hỗn hợp ban đầu c, Tính nồng độ % của các chất trong dd B
a)
Fe +2 HCl --> FeCl2+ H2
R + 2HCl --> RCl2 + H2
nhh = nH2= 0,672/22,3=0,03 mol
=> M trung bình =1,52/ 0,03= 50,6
Vì MFe=56> Mtb => R<50,6
nH2SO4= 49.8%/98= 0,04 mol
R + H2SO4 --> RSO4 +H2
axit dư => nR phản ứng = nH2SO4 phản ứng <0,04
=> R>1,52/0,04= 38
Suy ra 38< R< 50,6, R hóa trị II
Vậy R là Canxi (Ca) . R =40
b)
Có nFe +nCa= 0,03mol
m hh=56nFe +40nCa =1,52
=> n Fe = 0,02 mol ; n Ca = 0,01 mol
=> %mFe, %mCa
c)
nHCl = 2nH2 =0,06 mol
=> mddHCl =36,5.0,06.100/15=14,6g
mddB= m hhkl + m ddHCl - mH2 = 1,52+ 14,6 -0,03.2= 16,06 g
dd B có FeCl2 0,02 mol và CaCl2 0,01 mol
=> C%.
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 1,52g hỗn hợp gồm 2 kim loại là Fe và R(có hóa trị II) trong dd HCl 15% vừa đủ, thu được 672ml khí (đktc) và dd B. Nếu hòa tan 1,52g kim loại R trong 49gam dd H2SO4 8% thì lượng axit còn dư. a,Xác định tên kim loại R b,Tính thành phần % về khối lượng mỗi kim loại trong hỗn hợp ban đầu c, Tính nồng độ % của các chất trong dd B
Hòa tan 1,52g hh Fe và kim loại R có hóa trị II trong dd HCl 15% vừa đủ thu được 0,672lit khí (đktc) và dd B. Nếu hòa tan 1,52g kim loại R trong 49g dd H2SO4 8% thì lượng axit còn dư
a) xác định kl A
==========
Fe +2 HCl --> FeCl2+ H2
R + 2HCl --> RCl2 + H2
nhh = nH2= 0,672/22,3=0,03 mol
=> M trung bình =1,52/ 0,03= 50,6
Vì MFe=56> Mtb => R<50,6
nH2SO4= 49.8%/98= 0,04 mol
R + H2SO4 --> RSO4 +H2
axit dư => nR phản ứng = nH2SO4 phản ứng <0,04
=> R>1,52/0,04= 38
Suy ra 38< R< 50,6, R hóa trị II
Vậy R là Canxi (Ca) . R =40
Có nFe +nCa= 0,03mol
m hh=56nFe +40nCa =1,52
=> n Fe = 0,02 mol ; n Ca = 0,01 mol
=> %mFe, %mCa
c) tính nồng độ phần trăm của các chất trong dd B
nHCl = 2nH2 =0,06 mol
=> mddHCl =36,5.0,06.100/15=14,6g
mddB= m hhkl + m ddHCl - mH2 = 1,52+ 14,6 -0,03.2= 16,06 g
dd B có FeCl2 0,02 mol và CaCl2 0,01 mol
=> C%=bạn tự làm nha
Đúng 1
Bình luận (0)
bài 1:cho 7,2g kim loại hóa trị II phản ứng hoàn toàn 100ml dung dịch HCL 6M. Xác định tên kim loại đã dùng
baì 2: hòa tan hoàn toàn 7,56g kim loại R có hóa trị III vào dung dịch axit HCL thu được 9,408 lít H2 (đktc). Tìm kim loại R
Giúp mik vs ạ ! Cảm ơn
Bài 1:
Gọi KL cần tìm là A.
PT: \(A+2HCl\rightarrow ACl_2+H_2\)
Ta có: \(n_{HCl}=0,1.6=0,6\left(mol\right)\)
Theo PT: \(n_A=\dfrac{1}{2}n_{HCl}=0,3\left(mol\right)\)
\(\Rightarrow M_A=\dfrac{7,2}{0,3}=24\left(g/mol\right)\)
Vậy: KL cần tìm là Mg.
Đúng 1
Bình luận (0)
Bài 2:
PT: \(2R+6HCl\rightarrow2RCl_3+3H_2\)
Ta có: \(n_{H_2}=\dfrac{9,408}{22,4}=0,42\left(mol\right)\)
Theo PT: \(n_R=\dfrac{2}{3}n_{H_2}=0,28\left(mol\right)\)
\(\Rightarrow M_R=\dfrac{7,56}{0,28}=27\left(g/mol\right)\)
Vậy: R là Al.
Đúng 1
Bình luận (0)
hòa tan hoàn toàn b (g) oxit kim loại có hóa trị II bằng 1 lượng vừa đủ dung dịch H2SO4 15,8% thu được dung dịch muối có nồng độ 22,959% . Xác định tên oxit kim loại
CT oxit : MO
Đặt số mol oxit phản ứng là 1 mol
\(MO+H_2SO_4\rightarrow MSO_4+H_2O\)
\(m_{ddH_2SO_4}=\dfrac{1.98}{15,8\%}=620,25\left(g\right)\)
\(m_{ddsaupu}=620,25+M+16=M+636,25\left(g\right)\)
Ta có : \(C\%_{MSO_4}=\dfrac{M+96}{M+636,25}.100=22,959\)
=> M=65 (Zn)
=> Oxit kim loại : ZnO (Kẽm oxit)
Đúng 3
Bình luận (0)





















