với cùng khối lượng kim loại nào dưới đây tác dụng với axit clohiđric cho thể tích hidro do ở cùng điều kiện tiêu chuẩn nhiệt độ và áp suất lớn nhất
a kẽm B sắt C nhôm d nitơ Giai chi tiết giúp minh với!
Những câu hỏi liên quan
Với cùng khối lượng, kim loại nào cho dưới đây tác dụng với axit HCl cho thể tích H2 (đo ở cùng điều kiện nhiệt độ và áp suất) lớn nhất?
a. Al
b. Zn
c. Fe
d. Mg
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\dfrac{m}{27}\) \(\dfrac{m}{18}\) ( mol )
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(\dfrac{m}{65}\) \(\dfrac{m}{65}\) ( mol )
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(\dfrac{m}{56}\) \(\dfrac{m}{56}\) ( mol )
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(\dfrac{m}{24}\) \(\dfrac{m}{24}\) ( mol )
Ta có:
\(\dfrac{m}{18}< \dfrac{m}{24}< \dfrac{m}{56}< \dfrac{m}{65}\)
=> Al cho nhiều H2 nhất
Đúng 0
Bình luận (0)
Cho kim loại sắt tác dụng với axit HCl thu được sắt (II) clorua và khí H2
a) Tính khối lượng sắt và khối lượng axit biết thể tích hidro bằng 3,36 lít (ở điều kiện tiêu chuẩn).
b) tính khối lượng sắt clorua (FeCl2) tạo thành.
a) \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,15<--0,3<-----0,15<--0,15
=> \(m_{Fe}=0,15.56=8,4\left(g\right)\)
=> \(m_{HCl}=0,3.36,5=10,95\left(g\right)\)
b) \(m_{FeCl_2}=0,15.127=19,05\left(g\right)\)
Đúng 2
Bình luận (0)
Cho các kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng. a) Viết các phương trình phản ứng. b) Cho cùng một khối lượng các kim loại trên tác dụng hết với axit sunfuric? Kim loại nào cho nhiều khi hiđro nhất? c) Nếu thu được cùng một thể tích khí hiđro thì khối lượng kim loại nào nhỏ nhất?
Đọc tiếp
Cho các kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.
a) Viết các phương trình phản ứng.
b) Cho cùng một khối lượng các kim loại trên tác dụng hết với axit sunfuric? Kim loại nào cho nhiều khi hiđro nhất?
c) Nếu thu được cùng một thể tích khí hiđro thì khối lượng kim loại nào nhỏ nhất?
a) Phương trình phản ứng:
Zn + H2SO4 → ZnSO4 + H2
Fe + H2SO4loãng → FeSO4 + H2
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2
b) Giả sử cho cùng một khối lượng là a g kim loại kẽm sắt và nhôm
Zn + H2SO4 → ZnSO4 + H2 (1)
Fe + H2SO4loãng → FeSO4 + H2 (2)
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2 (3)
Ta có 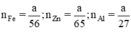
Theo pt nH2 (1) = nZn = 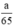 mol
mol
nH2 (2) = nFe = 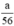 mol
mol
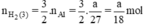
Như vậy ta nhận thấy 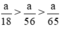 ⇒ nH2 (3) > nH2 (2) > nH2 (1)
⇒ nH2 (3) > nH2 (2) > nH2 (1)
Như vậy cho cùng một lượng kim loại tác dụng với axit H2SO4 loãng dư thì nhôm cho nhiều khí hidro hơn, sau đó đến sắt và ít nhất là kẽm
c) Nếu thu được cùng một lượng khí hidro thì khối lượng kim loại ít nhất là nhôm, sau đó đến sắt, cuối cùng là kẽm.
Đúng 1
Bình luận (0)
Cho các kim loại : kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.a, Viết các phương trình phản ứngb, Cho cùng một khối lượng các kim loại trên tác dụng hết với axit thì kim loại nào cho nhiều khí hidro nhất ?c, Nếu thu được cùng một thể tích khí hidro thì khối lượng kim loại nào dùng cho phản ứng là nhỏ nhất ? giúp mình nhé các bạn ?
Đọc tiếp
Cho các kim loại : kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.
a, Viết các phương trình phản ứng
b, Cho cùng một khối lượng các kim loại trên tác dụng hết với axit thì kim loại nào cho nhiều khí hidro nhất ?
c, Nếu thu được cùng một thể tích khí hidro thì khối lượng kim loại nào dùng cho phản ứng là nhỏ nhất ?
giúp mình nhé các bạn ?
Với cùng khối lượng, kim loại nào dưới đây khi tác dụng với dung dịch HCl sẽ tạo ra thể tích khí hiđro (ở điều kiện tiêu chuẩn) lớn nhất?(Biết: Al=27, Mg=24, Fe=56, Zn=65, H=1, Cl=35,5)
Với cùng khối lượng, kim loại nào dưới đây khi tác dụng với dung dịch HCl sẽ tạo ra thể tích khí hiđro (ở điều kiện tiêu chuẩn) lớn nhất?(Biết: Al=27, Mg=24, Fe=56, Zn=65, H=1, Cl=35,5) *
Al.
Fe.
Zn.
Mg.
\(2Al+6HCl\rightarrow2AlCl_3+H_2\)
\(\dfrac{m}{27}\) \(\dfrac{m}{54}\) ( mol )
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(\dfrac{m}{56}\) \(\dfrac{m}{56}\) ( mol )
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(\dfrac{m}{65}\) \(\dfrac{m}{65}\) ( mol )
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(\dfrac{m}{24}\) \(\dfrac{m}{24}\) ( mol )
So sánh:
\(\dfrac{m}{24}< \dfrac{m}{54}< \dfrac{m}{56}< \dfrac{m}{65}\)
=> Kim loại Mg cho nhiều H2 nhất
Đúng 2
Bình luận (0)
Cho 3,375 gam nhôm tác dụng vừa đủ với dung dịch axit clohiđric sơ đồ phản ứng:
Al + HCl ---> AlCl3 + H2
a tính thể tích khí hidro được sinh ra ở điều kiện tiêu chuẩn b tính khối lượng muối nhôm clorua AlCl3 tạo thành
Xem chi tiết
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(n_{Al}=\dfrac{3,375}{27}=0,125\)
\(\Rightarrow n_{H_2}=\dfrac{0,125}{2}.3=0,1875mol\) \(\Rightarrow V_{H_2}=0,1875.22,4=4,2l\)
\(n_{AlCl_3}=n_{Al}=0,125mol\) \(\Rightarrow m_{AlCl_3}=0,125.133,5=16,6875g\)
Đúng 2
Bình luận (0)
Cho kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.
a. Viết các phương trình hóa học của các phản ứng.
b. Cho cùng một khối lượng các kim loại trên tác dụng hết với axit dư thì kim loại nào cho nhiều khí hidro nhất?
c. Nếu thu được cùng một thể tích khí hidro thì khối lượng của kim loại nào đã phản ứng là nhỏ nhất?
a)
$Zn + H_2SO_4 \to ZnSO_4 + H_2(1)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2(2)$
$Fe + H_2SO_4 \to FeSO_4 + H_2(3)$
b)
Coi m Zn = m Al = m Fe = 100(gam)
\(n_{H_2(1)} = n_{Zn} = \dfrac{100}{65}(mol)\\ n_{H_2(2)} = \dfrac{3}{2}n_{Al} = \dfrac{3}{2}.\dfrac{100}{27} = \dfrac{100}{18}(mol)\\ n_{H_2(3)} = n_{Fe} = \dfrac{100}{56}(mol)\\\)
Ta thấy :
\(n_{H_2(1)} < n_{H_2(3)} < n_{H_2(2)}\) nên dùng kim loại Al cho được nhiều khí hidro nhất.
c) Coi $n_{H_2} = 1(mol)$
n Zn = n H2 = 1(mol) => m Zn = 1.65 = 65(gam)
n Al = 3/2 n H2 = 1,5(mol) => m Al = 1,5.27 = 40,5(gam)
n Fe = n H2 = 1(mol) => m Fe = 1.56 = 56(gam)
Vậy cùng một thể tích hidro thì Al có khối lượng nhỏ nhất
Đúng 2
Bình luận (0)
a, PT: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\) (1)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\) (2)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\) (3)
b, Giả sử: mZn = mAl = mFe = a (g)
\(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{Al}=\dfrac{a}{27}\left(mol\right)\\n_{Fe}=\dfrac{a}{56}\left(mol\right)\end{matrix}\right.\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2\left(1\right)}=n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{H_2\left(2\right)}=\dfrac{3}{2}n_{Al}=\dfrac{a}{18}\left(mol\right)\\n_{H_2\left(3\right)}=n_{Fe}=\dfrac{a}{56}\left(mol\right)\end{matrix}\right.\)
⇒ Al cho nhiều khí H2 nhất.
c, Giả sử: nH2 (1) = nH2 (2) = nH2 (3) = b (mol)
Theo PT: \(\left\{{}\begin{matrix}n_{Zn}=n_{H_2\left(1\right)}=b\left(mol\right)\\n_{Al}=\dfrac{2}{3}n_{H_2\left(2\right)}=\dfrac{2}{3}b\left(mol\right)\\n_{Fe}=n_{H_2\left(3\right)}=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Zn}=65b\left(g\right)\\m_{Al}=\dfrac{2}{3}b.27=18b\left(g\right)\\m_{Fe}=56b\left(g\right)\end{matrix}\right.\)
⇒ Khối lượng Al pư là nhỏ nhất.
Đúng 1
Bình luận (0)
Tham Khảo :
a) PTHH:
\(\begin{array}{l} \mathrm{Zn}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{ZnSO}_{4}+\mathrm{H}_{2} \\ \mathrm{Fe}+\mathrm{H}_{2} \mathrm{SO}_{4 \text { loãng }} \rightarrow \mathrm{FeSO}_{4}+\mathrm{H}_{2} \\ 2 \mathrm{Al}+3 \mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{Al}_{2}\left(\mathrm{SO}_{4}\right)_{3}+3 \mathrm{H}_{2} \end{array}\)
b) Giả sử một khối lượng là \(\text{a (g)}\) kim loại kẽm sắt và nhôm cho cùng:
\(\begin{array}{l} \mathrm{Zn}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{ZnSO}_{4}+\mathrm{H}_{2}\\ \mathrm{Fe}+\mathrm{H}_{2} \mathrm{SO}_{4 \text { loãng }} \rightarrow \mathrm{FeSO}_{4}+\mathrm{H}_{2}\\ 2 \mathrm{Al}+3 \mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{Al}_{2}\left(\mathrm{SO}_{4)_{3}}+3 \mathrm{H}_{2}\right.\\ \text { Ta có } \mathrm{n}_{\mathrm{Fe}}=\frac{\mathrm{a}}{56} ; \mathrm{n}_{\mathrm{Zn}}=\frac{\mathrm{a}}{65} ; \mathrm{n}_{\mathrm{Al}}=\frac{\mathrm{a}}{27}\\ \text { Theo } \mathrm{pt} \mathrm{n}_{\mathrm{H}_{2}}(1)=\mathrm{n}_{\mathrm{Zn}}=\frac{\mathrm{a}}{65} \mathrm{~mol}\\ \mathrm{n}_{\mathrm{H}_{2}(2)}=\mathrm{n}_{\mathrm{Fe}}=\frac{\mathrm{a}}{56} \mathrm{~mol} \end{array}\)\(\begin{array}{l} \mathrm{n}_{\mathrm{H}_{2}(3)}=\frac{3}{2} \cdot \mathrm{n}_{\mathrm{A} 1}=\frac{3}{2} \cdot \frac{\mathrm{a}}{27}=\frac{\mathrm{a}}{18} \mathrm{~mol}\\ \text { Như vậy ta nhận thấy } \frac{a}{18}>\frac{a}{56}>\frac{a}{65} \Rightarrow \mathrm{n}_{H_{2}}(3)>\mathrm{n}_{\mathrm{H}_{2}}(2)>\mathrm{n}_{\mathrm{H}_{2}}(1) \end{array}\)
Vậy cho cùng một lượng kim loại tác dụng với axit H2SO4 loãng dư thì nhôm cho nhiều khí hidro hơn, sau đó đến sắt và ít nhất là kẽm
c) Nếu thu được cùng một lượng khí hidro thì khối lượng kim loại ít nhất là nhôm, sau đó đến sắt, cuối cùng là kẽm.
Đúng 1
Bình luận (0)
Câu 10. Lấy cùng một khối lượng mỗi kim loại kẽm, nhôm, magie, sắt lần lượt tác dụng hết với dung dịch axit sunfuric loãng, dư. Phản ứng tạo ra nhiều hiđro nhất là của A. sắt. B. kẽm. C. magie. D. nhôm
làm chi tiết rồi mới chọn đáp án nha
























