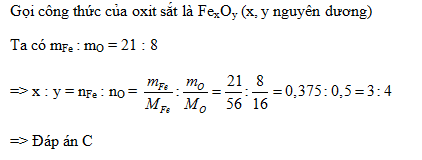Biết 24,8g photpho kết hợp với oxi tạo ra 56,8g oxit của photpho. Tìm cthh của oxit photpho

Những câu hỏi liên quan
đốt cháy hoàn toàn 3.1 g photpho trong oxi thu được 7.1 g oxit photpho. Tìm CTHH đơn giản nhất của hợp chất
a)Lập CTHH một laoij oxit của photpho ,biết rằng hóa trị của photpho là V
b) Lập CTHH của crom(III)oxit
a. Công thức hóa học là : P2O5
b. Công thức hóa học là : Cr2O3
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
a)tìm cthh của oxit axit .Biết photpho chiếm 43,66% khối lượng
b)cho 14,2g oxit trên tan trong 38g H2O .Tính khối lượng oxit thu được
a) P:O=\(\dfrac{43,66\%}{31}:\dfrac{100\%-43,66\%}{16}\)\(\approx\)2:5.
CTHH của oxit cần tìm là P2O5.
Bạn kiểm tra đề câu b giúp mình!
Có thể bạn tìm: "b) Cho 14,2 gam oxit trên tan trong 38 gam H2O. Tính khối lượng axit thu được.
Giải:
b) P2O5 (0,1 mol) + 3H2O \(\rightarrow\) 2H3PO4 (0,2 mol).
Số mol của P2O5 và H2O lần lượt là 14,2:142=0,1 (mol) và 38:18=19/9>0,3 (mol).
Khối lượng axit thu được là 0,2.98=19,6 (g).".
Đúng 2
Bình luận (0)
Bài 1: Tìm thể tích khí O2 (đktc) cần dùng để đốt cháy hoàn toàn 6,2 gam Photpho tạo ra hợp chất đi photpho penta oxit (P2O5). (Cho biết: P = 31; O = 16
\(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
PTHH : 4P + 5O2 -> 2P2O5
=> \(n_{P_2O_5}=\dfrac{1}{2}n_P=0,1\left(mol\right)\)
=> \(m_{P_2O_5}=0,1.142=14,2\left(g\right)\)
Theo ĐLBTKL
\(m_P+m_{O_2}=m_{P_2O_5}\\ =>m_{O_2}=14,2-6,2=8\left(g\right)\)
=> \(n_{O_2}=\dfrac{8}{32}=0,25\left(mol\right)\\ V_{O_2}=0,25.22,4=5,6\left(l\right)\)
Đúng 3
Bình luận (0)
\(n_P=\dfrac{6.2}{31}=0.2\left(mol\right)\)
\(4P+5O_2\underrightarrow{^{^{t^0}}}2P_2O_5\)
\(0.2........0.25\)
\(V_{O_2}=0.25\cdot22.4=5.6\left(l\right)\)
Đúng 5
Bình luận (0)
Đốt cháy hoàn toàn 18,6 gam photpho trong bình chứa oxi, ta thu được một bột trắng là photpho (V) oxit.a) Viết phương trình phản ứng xảy rab) Tính thể tích khí oxi (đktc) đã tham gia phản ứngc) Tính khối lượng mol photpho (V) oxit được tạo thành d) Hòa tan hoàn toàn lượng photpho (V) oxit thu được ở trên vào trong nước. Tính khối lượng H3PO4 được tạo thành-------------------------------------------------------------------- Mong các bạn giải giúp mình -------------------------------------------...
Đọc tiếp
Đốt cháy hoàn toàn 18,6 gam photpho trong bình chứa oxi, ta thu được một bột trắng là photpho (V) oxit.
a) Viết phương trình phản ứng xảy ra
b) Tính thể tích khí oxi (đktc) đã tham gia phản ứng
c) Tính khối lượng mol photpho (V) oxit được tạo thành
d) Hòa tan hoàn toàn lượng photpho (V) oxit thu được ở trên vào trong nước. Tính khối lượng H3PO4 được tạo thành
-------------------------------------------------------------------- Mong các bạn giải giúp mình ----------------------------------------------------------------------------------
4P2+5)2 ---> 2P2O5
Lần lượt tính mol các chất theo tỉ lệ là đc
d) P2O5 + 3H2O ---> 2H3PO4
Đúng 0
Bình luận (0)
Lập CTHH của oxit:
a) Sắt oxit có tỉ số khối lượng sắt và oxi là 21 : 8 . b) Một oxit của photpho có thành phần phần trăm cuả P bằng 43,66%. Biết PTK của oxit bằng 1421
Đặt CT: FexOy
Ta có:
MFe:MO=56x\16y= 21\8= 448x\336y
⇒ x\y= 3\4
⇒ x = 3 ; y = 4
⇒ CT của oxit sắt: Fe3O4
⇒ Fe3O4 có PTK: 3.56+4.16 = 232 đvC
2.
Gọi công thức hóa học của oxit photpho là PxOy
Lập các tỷ số khối lượng:
x×31\142=43,66\100→x≈2
y×16\142=56,34\100→y=5
Công thức hóa học của oxit photpho là P2O5
Đúng 0
Bình luận (0)
cho mình hỏi chỗ là 21/8=448x/336y là sao z ???
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
đốt cháy 6 2 gam photpho trong đó 4,48 lít khí oxi thu được đi photpho penta oxit
a viết PHH của phản ứng xảy ra
b chất nào dư ? dư bao nhiêu mol?
c. tính khối lượng đi photpho penta oxit tạo ra
GIẢI GIÚP MIK VS DAG CẦN GẤP Ạ
Tóm tắt:
mP = 6.2 g
VO2 = 4,48g
__________________________________________________
a. PTHH
b. Chất nào dư? dư bao nhiêu mol?
c.mP2O5 = ?
a. 4 P + 5 O2 ----------- 2 P2O5
4mol 5 mol 2mol
0,2 mol
b. Số mol P là: n =\(\dfrac{m}{M}\)=\(\dfrac{6,2}{31}\)= 0,2 mol
Số mol O2 là: n =\(\dfrac{V}{22,4}\)=\(\dfrac{4,48}{22,4}\) = 0,2 mol
Lập tỉ lệ : \(\dfrac{0,2}{4}\) < \(\dfrac{0,2}{5}\) => O2 dư
Số mol dư : nO2 = nbd - nphân huỷ
= 0,2 - \(\dfrac{0,2.4}{5}\)= 0,04 mol
c. Số mol P2O5 : \(\dfrac{0,2.2}{4}\)=0,1
Khối lượng P2O5 : m = n.M= 0,1 . 142 = 14,2g
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 3.1 g photpho (P) với khí Oxi, tạo thành 7.1 g hợp chất photpho oxit (PxOy)
a/ Viết sơ đồ phản ứng
b/ Tính khối lượng của Oxi tham gia phản ứng.
c/ Xác định công thức hóa học cua photpho oxit (PxOy)
@Cẩm Vân Nguyễn Thị
Hùng Nguyễn
Khả Vân
Nguyễn Trần Thành Đạt
Đúng 0
Bình luận (0)
a) 2xP + yO2 \(\underrightarrow{to}\) 2PxOy
b) Theo ĐL BTKL ta có:
\(m_P+m_{O_2}=m_{P_xO_y}\)
\(\Leftrightarrow m_{O_2}=m_{P_xO_y}-m_P=7,1-3,1=4\left(g\right)\)
c) \(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
Theo PT: \(n_{P_xO_y}=\dfrac{1}{x}n_P=\dfrac{1}{x}\times0,1=\dfrac{0,1}{x}\left(mol\right)\)
\(\Rightarrow M_{P_xO_y}=7,1\div\dfrac{0,1}{x}\)
\(\Leftrightarrow31x+16y=71x\)
\(\Leftrightarrow16y=40x\)
\(\Rightarrow\dfrac{x}{y}=\dfrac{16}{40}=\dfrac{2}{5}\left(tốigiản\right)\)
Vậy \(x=2;y=5\)
Vậy CTHH là P2O5
Đúng 0
Bình luận (0)
Một hợp chất A tạo bởi 2 ng tố photpho và oxi. Trong hợp chất này, photpho chiếm 43,66% về khối lượng. Xác định CTHH của hợp chất A.
Gọi CTHH của A là $P_xO_y$
Ta có :
$\%P = \dfrac{31x}{31x + 16y}.100\% = 43,66\%$
$\Rightarrow \dfrac{x}{y} = \dfrac{2}{5}$
Vậy A là $P_2O_5$
Đúng 2
Bình luận (0)