- Ta có:
+ L có Z = 8
+ D có Z = 9
+ E có Z = 8
+ G có Z = 7
=> Nguyên tử L và E thuộc cùng 1 nguyên tố hóa học vì có cùng số đơn vị điện tích hạt nhân (Z = 8)
- Ta có:
+ L có Z = 8
+ D có Z = 9
+ E có Z = 8
+ G có Z = 7
=> Nguyên tử L và E thuộc cùng 1 nguyên tố hóa học vì có cùng số đơn vị điện tích hạt nhân (Z = 8)
Xác định được: nguyên tử khối, nguyên tử khối trung bình và phần trăm số nguyên tử các đồng vị của một nguyên tố hóa học.
Giải thích được vì sao nguyên tử khối của các nguyên tố hóa học không phải là các trị số nguyên và hiểu được sự đa dạng của nguyên tố hóa học trong tự nhiên thông qua khái niệm đồng vị.
Hãy biểu diễn kí hiệu của một số nguyên tử sau:
a) Nitrogen (số proton = 7 và số neutron = 7)
b) Phosphorus (số proton = 15 và số neutron = 16)
c) Copper (số proton = 29 và số neutron = 34)
Vì sao trong bảng tuần hoàn các nguyên tố hóa học, giá trị nguyên tử khối của chromium (Cr) không phải là số nguyên mà là 51,996?
Kí hiệu một nguyên tử cho biết những thông tin gì? Cho ví dụ.
Copper (đồng) được sử dụng làm dây dẫn điện, huy chương, trống đồng… Nguyên tử khối trung bình của copper bằng 63,546. Copper tồn tại trong tự nhiên dưới hai dạng đồng vị 6329Cuvà 6529Cu. Tính phần trăm số nguyên tử của đồng vị 6329Cu tồn tại trong tự nhiên.
Tỉ lệ phần trăm số nguyên tử các đồng vị của neon (Ne) được xác định theo phổ khối lượng (Hình 2.4). Tính nguyên tử khối trung bình của Ne.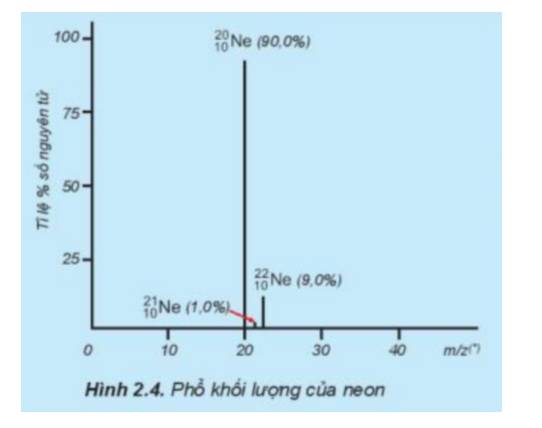
Các nguyên tử có cùng số đơn vị điện tích hạt nhân thì có đặc điểm gì chung? Giữa số đơn vị điện tích hạt nhân, số proton và số electron có mối liên hệ như thế nào?
Xác định thành phần nguyên tử (số proton, neutron, electron) của mỗi đồng vị sau:
a) \(^{28}_{14}Si\), \(^{29}_{14}Si\), \(^{30}_{14}Si\)
b) \(^{54}_{26}Fe\), \(^{56}_{26}Fe\), \(^{57}_{26}Fe\), \(^{58}_{26}Fe\)