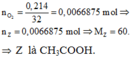Câu 2. Trung hoà 400 mL dung dịch acetic acid 0,5 M bằng dung
dịch NaOH 0,5 М.
a. Viết PTHH.
trung hoà V ml dung dịch hcl 0,5 bằng 200 ml dung dịch naoh 1m. giá trị của V là
HCl+NaOH->NaCl+H2O
0,2-----0,2 mol
n NaOH=1.0,2=0,2 mol
=>V HCl=\(\dfrac{0,2}{0,5}\)=0,4l=400ml
Chuẩn bị: Cồn 96°, acetic acid nguyên chất, dung dịch H2SO4 đặc, dung dịch NaCl bão hoà, ống nghiệm.
Tiến hành: Cho 1 mL cồn 96° vào trong ống nghiệm. Cho tiếp vào trong ống nghiệm 1 mL acetic acid nguyên chất. Thêm vào ống nghiệm 1 – 2 giọt dung dịch sulfuric acid đậm đặc và lắc đều, dùng bông sạch nút miệng ống nghiệm. Sau đó, đun cách thuỷ trong cốc thuỷ tinh ở nhiệt độ 65 – 70 °C trong khoảng thời gian 5 – 7 phút. Làm lạnh ống nghiệm rồi cho thêm vào 2 mL dung dịch sodium chloride bão hoà. Để yên ống nghiệm.
Yêu cầu: Quan sát, mô tả hiện tượng và giải thích.
Chú ý an toàn: Cẩn thận khi làm việc với dung dịch H2SO4 đặc.
Hiện tượng: Phản ứng sinh ra chất lỏng, nhẹ hơn nước, có mùi thơm đặc trưng.
Giải thích bằng phương trình hoá học:
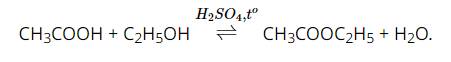
Trung Hoà 200 ml dung dịch axit acetic 1M cần vừa đủ 100 g dung dịch NaOH chưa rõ nông độ a . Viết Phương trinh Hoá học b . Tính khoi lương của natri axetat tạo thành sau phan ưng c . Tính nông độ phần trăm của dung dịch NaOH đã dùng
a, \(CH_3COOH+NaOH\rightarrow CH_3COONa+H_2O\)
b, \(n_{CH_3COOH}=0,2.1=0,2\left(mol\right)\)
Theo PT: \(n_{NaOH}=n_{CH_3COONa}=n_{CH_3COOH}=0,2\left(mol\right)\)
\(\Rightarrow m_{CH_3COONa}=0,2.82=16,4\left(g\right)\)
c, \(C\%_{NaOH}=\dfrac{0,2.40}{100}.100\%=8\%\)
a) Rút gọn biểu thức A:
A = 3/(sqrt(7) - 2) + sqrt((sqrt(7) - 3) ^ 2)
= 3/(sqrt(7) - 2) + sqrt(7 - 6sqrt(7) + 9)
= 3/(sqrt(7) - 2) + sqrt(16 - 6sqrt(7))
= 3/(sqrt(7) - 2) + 2sqrt(2 - sqrt(7))
Rút gọn biểu thức B:
B = ((sqrt(x))/(sqrt(x) - 1) - (sqrt(x))/(x - sqrt(x))) / ((sqrt(x) + 1)/(x - 1))
= (x - x(sqrt(x) - 1) - sqrt(x)(sqrt(x) - 1)) / ((sqrt(x) - 1)(sqrt(x) + 1))
= (x - x^(3/2) - x + x^(3/2)) / (x - 1)
= x /(x - 1)
b) Ta cần tìm các giá trị của x (x > 0, x ≠ 1) để A = B:
3/(sqrt(7) - 2) + 2sqrt(2 - sqrt(7)) = x /(x - 1)
Đặt y = sqrt(7)
Ta có:
3/(sqrt(7) - 2) + 2sqrt(2 - sqrt(7)) = x /(x - 1)
<=> 3/(y - 2) + 2sqrt(2 - y) = x /(x - 1) (1)
và
x /(x - 1) = y /(y - 1) (2)
Từ (2), suy ra:
x = y/(y - 1) * (x - 1)
= (y * x - x - y) / (y - 1)
=> x = y /(y - x - 1)
Thay x vào (1), ta được:
3/(y - 2) + 2sqrt(2 - y) = y /(y - x - 1)
<=> y^2 - y - 3 - 2y^2 * sqrt(2 - y) + 2(y - x - 1)sqrt(2 - y) - x - 3x*sqrt(2 - y) = 0
Để giải phương trình này, cần dùng các phương pháp số học. Kết quả tìm được là:
x = 7 - 4sqrt(2), x = 1/4
Vậy, các giá trị của x để A = B là x = 7 - 4sqrt(2) và x = 1/4.
a) Rút gọn biểu thức A:
A = 3/(sqrt(7) - 2) + sqrt((sqrt(7) - 3) ^ 2)
= 3/(sqrt(7) - 2) + sqrt(7 - 6sqrt(7) + 9)
= 3/(sqrt(7) - 2) + sqrt(16 - 6sqrt(7))
= 3/(sqrt(7) - 2) + 2sqrt(2 - sqrt(7))
Rút gọn biểu thức B:
B = ((sqrt(x))/(sqrt(x) - 1) - (sqrt(x))/(x - sqrt(x))) / ((sqrt(x) + 1)/(x - 1))
= (x - x(sqrt(x) - 1) - sqrt(x)(sqrt(x) - 1)) / ((sqrt(x) - 1)(sqrt(x) + 1))
= (x - x^(3/2) - x + x^(3/2)) / (x - 1)
= x /(x - 1)
b) Ta cần tìm các giá trị của x (x > 0, x ≠ 1) để A = B:
3/(sqrt(7) - 2) + 2sqrt(2 - sqrt(7)) = x /(x - 1)
Đặt y = sqrt(7)
Ta có:
3/(sqrt(7) - 2) + 2sqrt(2 - sqrt(7)) = x /(x - 1)
<=> 3/(y - 2) + 2sqrt(2 - y) = x /(x - 1) (1)
và
x /(x - 1) = y /(y - 1) (2)
Từ (2), suy ra:
x = y/(y - 1) * (x - 1)
= (y * x - x - y) / (y - 1)
=> x = y /(y - x - 1)
Thay x vào (1), ta được:
3/(y - 2) + 2sqrt(2 - y) = y /(y - x - 1)
<=> y^2 - y - 3 - 2y^2 * sqrt(2 - y) + 2(y - x - 1)sqrt(2 - y) - x - 3x*sqrt(2 - y) = 0
Để giải phương trình này, cần dùng các phương pháp số học. Kết quả tìm được là:
x = 7 - 4sqrt(2), x = 1/4
Vậy, các giá trị của x để A = B là x = 7 - 4sqrt(2) và x = 1/4.
Cho 100 cm3 dung dịch H2SO4 0,5 M vào 200 cm3 dung dịch HCl 1M thu được 300 ml dung dịch A
a. Tính nồng độ mol/l của ion H+ trong dung dịch A
b. Tính thể tích dung dịch KOH 0,5 M để trung hoà 30 cm3 dung dịch A.
c. Nếu dùng V’ cm3 dung dịch chứa 2 hidroxit là Ba(OH)2 1M và KOH 0,5 M để trung hoà 30 cm3 dd A.
Ø Viết phương trình phản ứng xảy ra dạng ion
Ø Tính thể tích V’ và khối lượng kết tủa thu được .
Cho 100 cm3 dung dịch H2SO4 0,5 M vào 200 cm3 dung dịch HCl 1M thu được 300 ml dung dịch A
a. Tính nồng độ mol/l của ion H+ trong dung dịch A
b. Tính thể tích dung dịch KOH 0,5 M để trung hoà 30 cm3 dung dịch A.
c. Nếu dùng V’ cm3 dung dịch chứa 2 hidroxit là Ba(OH)2 1M và KOH 0,5 M để trung hoà 30 cm3 dd A.
Ø Viết phương trình phản ứng xảy ra dạng ion
Ø Tính thể tích V’ và khối lượng kết tủa thu được .
Cho 50g dung dịch acetic acid CH3COOH tác dụng vùa đủ với 2,76 g Potassium carbonate K2CO3.
a. Tính nồng độ phần trăm dung dịch acetic acid đã dùng.
b. Nếu muốn thu được lượng acetic acid đã dùng ở trên thì càn len măn bao nhiều ml dung dịch ethanol 8 độ.
a, \(n_{K_2CO_3}=\dfrac{2,76}{138}=0,02\left(mol\right)\)
PT: \(2CH_3COOH+K_2CO_3\rightarrow2CH_3COOK+CO_2+H_2O\)
Theo PT: \(n_{CH_3COOH}=2n_{K_2CO_3}=0,04\left(mol\right)\)
\(\Rightarrow C\%_{CH_3COOH}=\dfrac{0,04.60}{50}.100\%=4,8\%\)
b, \(C_2H_5OH+O_2\underrightarrow{mengiam}CH_3COOH+H_2O\)
Theo PT: \(n_{C_2H_5OH}=n_{CH_3COOH}=0,04\left(mol\right)\Rightarrow m_{C_2H_5OH}=0,04.46=1,84\left(g\right)\)
\(\Rightarrow V_{C_2H_5OH}=\dfrac{1,84}{0,8}=2,3\left(ml\right)\)
\(\Rightarrow V_{C_2H_5OH\left(8^o\right)}=\dfrac{2,3}{8}.100=28,75\left(ml\right)\)
Cho 500 ml dung dịch H3PO4 0,5 M phản ứng hoàn toàn với 400 ml dung dịch chứa NaOH 0,625M và Ba(OH)2 0,5M, tổng khối lượng muối tạo thành là
A. 42,75
B. 53,73
C. 47,40
D. 57,00

→ mmuoi= 0,25 . 98 + 0,25 .40 + 0,2 . 171 – 0,65. 18 = 57 (g)
Đáp án D
Cho 500 ml dung dịch H3PO4 0,5 M phản ứng hoàn toàn với 400 ml dung dịch chứa NaOH 0,625M và Ba(OH)2 0,5M, tổng khối lượng muối tạo thành là
A. 42,75
B. 53,73
C. 47,40
D. 57,00
Đáp án D
Ta có: n H 3 P O 4 = 0 , 25 m o l → n H + = 0 , 75 m o l , n O H - = 0 , 65 m o l → O H - h ế t t r ư ớ c
H++OH−→H2O
Vậy phản ứng tổng là
H3PO4+NaOH+Ba(OH)2→muoi+H2O
Bảo toàn khối lượng ta có: m m u ố i = m H 3 P O 4 + m N a O H + m B a ( O H ) 3 - m H 2 O
m m u ố i = 0 , 25 . 98 + 0 , 25 . 40 + 0 , 2 . 171 - 0 , 65 . 18 = 57 g a m
Este X no đơn chức để lâu ngày bị thuỷ phân một phần tạo ra 2 chất hữu cơ Y và Z. Muốn trung hoà lượng axit tạo ra từ 13,92 gam X phải dùng 15 ml dung dịch NaOH 0,5 M. Để xà phòng hoá lượng este còn lại phải dùng thêm 225 ml dung dịch NaOH 0,5 M. Nếu oxi hoá Y sẽ được một anđehit có mạch phân nhánh. Khi hoá hơi 0,4 gam Z được thể tích bằng thể tích của 0,214 gam O2. Công thức este X là:
A. CH3COOCH2CH2CH2CH3.
B. CH3COOCH2CH(CH3)2.
C. CH3COOCH(CH3)CH2CH3
D. C2H5COOCH2CH(CH3)2.
Chọn B.
Este X thủy phân tạo 2 chất hữu cơ Y và Z. Trong đó Y bị oxi hóa thu được anđehit có nhánh nên Y phải là ancol bậc 1 có nhánh (loại đáp án A và C). Z là axit cacboxylic:
![]()
=> Z là CH3COOH.
Este X no đơn chức để lâu ngày bị thuỷ phân một phần tạo ra 2 chất hữu cơ Y và Z. Muốn trung hoà lượng axit tạo ra từ 13,92 gam X phải dùng 15 ml dung dịch NaOH 0,5 M. Để xà phòng hoá lượng este còn lại phải dùng thêm 225 ml dung dịch NaOH 0,5 M. Nếu oxi hoá Y sẽ được một anđehit có mạch phân nhánh. Khi hoá hơi 0,4 gam Z được thể tích bằng thể tích của 0,214 gam O2. Công thức este X là:
A. CH3COOCH2CH2CH2CH3.
B. CH3COOCH2CH(CH3)2.
C. CH3COOCH(CH3)CH2CH3.
D. C2H5COOCH2CH(CH3)2.
Chọn B.
Este X thủy phân tạo 2 chất hữu cơ Y và Z. Trong đó Y bị oxi hóa thu được anđehit có nhánh nên Y phải là ancol bậc 1 có nhánh (loại đáp án A và C). Z là axit cacboxylic: