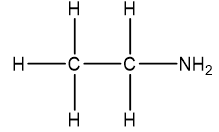
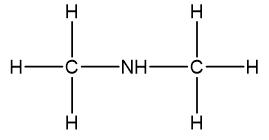
Xác định công thức phân tử của hợp chất hữu cơ X biết rằng X chứa 85,71 % C; 14,29%H.Biết 1 lít A ở đkc nặng 13gam

Những câu hỏi liên quan
Một hợp chất hữu cơ (X) có %C40 ; %H6,7 và %O53,3. Xác định công thức đơn giản nhất của X. biết rằng MX 180. Xác định công thức phân tử của X. A. C6H10 O6 B. C12H22O11 C. C6H12O6 D. C6H10O5
Đọc tiếp
Một hợp chất hữu cơ (X) có %C=40 ; %H=6,7 và %O=53,3. Xác định công thức đơn giản nhất của X. biết rằng MX =180. Xác định công thức phân tử của X.
A. C6H10 O6
B. C12H22O11
C. C6H12O6
D. C6H10O5
Đáp án C
Hướng dẫn:
Giả sử công thức phân tử của (X) là CxHyOz
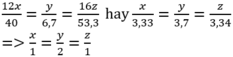
Vậy công thức đơn giản nhất của (X) là : CH2OH và công thức phân tử là Cn(H2O)n. Đây là công thức chung của monosaccarit với số phân tử H2O bằng số nguyên tử cacbon.
Với M = 180, ta có: (12+18).n =180 => n=6
Vậy công thức phân tử là: C6H12O6
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 9(g) hợp chất hữu cơ X thu được 5,04(g) H2 0 và 6,72(l) khí (đktc) lm đục nc vôi trg
a, hợp chất hữu cơ chứa những nguyên tố nào
b,xác định công thức phân tử của hợp chất hữu cơ trên biết phân tử khối X là 180
Sửa đề: 5,04 gam -> 5,4 gam
a)
Theo ĐLBTNT: \(\left\{{}\begin{matrix}n_H=2n_{H_2O}=2.\dfrac{5,4}{18}=0,6\left(mol\right)\\n_C=n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\n_O=\dfrac{9-0,3.12-0,6}{16}=0,3\left(mol\right)\end{matrix}\right.\)
Vậy X chứa C, H, O
b) Đặt CTPT của X là CxHyOz
\(\Rightarrow n_X=\dfrac{9}{180}=0,05\left(mol\right)\Rightarrow\left\{{}\begin{matrix}x=\dfrac{0,3}{0,06}=6\\y=\dfrac{0,6}{0,05}=12\\z=\dfrac{0,3}{0,05}=6\end{matrix}\right.\)
Vậy X là C6H12O6
Đúng 2
Bình luận (0)
Một hợp chất hữu cơ X chứa C,H,O.Đốt cháy hoàn toàn 3,0 gam X thu được 6,6 gam CO2 và 3,6 gam H2O. Xác định công thức phân tử của X, biết X có phân tử khối là 60
Xem chi tiết
\(n_C = n_{CO_2} = \dfrac{6,6}{44} = 0,15(mol)\\ n_H = 2n_{H_2O} = 2. \dfrac{3,6}{18} = 0,4(mol)\\ n_O = \dfrac{3-0,15.12-0,4.1}{16} = 0,05(mol)\\ n_X = \dfrac{3}{60} = 0,05(mol)\)
Suy ra:
Số nguyên tử Cacbon = \( \dfrac{n_C}{n_X} = \dfrac{0,15}{0,05} = 3\)
Số nguyên tử Hidro = \( \dfrac{n_H}{n_X} = \dfrac{0,4}{0,05} = 8\)
Số nguyên tử Oxi = \( \dfrac{n_O}{n_X} = \dfrac{0,05}{0,05} = 1\)
Vậy CTHH của X : C3H8O
Đúng 1
Bình luận (0)
Một hợp chất hữu cơ X chứa C,H,O.Đốt cháy hoàn toàn 3,0 gam X thu được 6,6 gam CO2 và 3,6 gam H2O. Xác định công thức phân tử của X, biết X có phân tử khối là 60
\(n_C=n_{CO_2}=\dfrac{6,6}{44}=0,15\left(mol\right)\)
\(n_H=2nH_2O=2.\dfrac{3,6}{18}=0,4\left(mol\right)\)
\(n_O=\dfrac{3-0,15.12-0,4.1}{16}=0,05\left(mol\right)\)
\(n_X=\dfrac{3}{60}=0,05\left(mol\right)\)
Suy ra:
Số nguyên tử Cacbon\(=\dfrac{n_C}{n_X}=\dfrac{0,15}{0,05}=3\)
Số nguyên tử Hidro\(=\dfrac{n_H}{n_X}=\dfrac{0,4}{0,05}=8\)
Số nguyên tử Oxi \(=\dfrac{n_O}{n_X}=\dfrac{0,05}{0,05}=1\)
Vậy CTHH của X : C3H8O
Đúng 2
Bình luận (0)
hợp chất hữu cơ X có chứa (C,H,N) có khối lượng mol phân tử là 45 gam. đốt cháy 0,1 mol X cho 1,12 lít nitơ .
a) xác định công thức phân tử của X
b) viết tất cả các công thức cấu tạo của X , biết N có hóa trị III
\(CT:C_xH_yN_t\)
\(n_{N_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(t=\dfrac{0.05\cdot2}{0.1}=1\)
\(M=12x+y+14=45\left(\dfrac{g}{mol}\right)\)
\(\Leftrightarrow12x+y=31\)
\(x\le2\)
\(\left[{}\begin{matrix}x=1\\x=2\end{matrix}\right.\Rightarrow\left[{}\begin{matrix}y=9\\y=7\end{matrix}\right.\)
\(CT:C_2H_7N\)
Các CTCT của X :
Đúng 2
Bình luận (0)
Hợp chất hữu cơ A chứa C, H, N, O gồm 63,72%C, 12,39%N, 9,73%H về khối lượng. Xác định công thức phân tử của A biết rằng A có khối lượng phân tử nhỏ hơn 115 đvC. A. C6H13O2N B. C6H11ON C.C6H14ON2 D. C6H7ON
Đọc tiếp
Hợp chất hữu cơ A chứa C, H, N, O gồm 63,72%C, 12,39%N, 9,73%H về khối lượng. Xác định công thức phân tử của A biết rằng A có khối lượng phân tử nhỏ hơn 115 đvC.
A. C6H13O2N
B. C6H11ON
C.C6H14ON2
D. C6H7ON
Đáp án B
Gọi công thức phân tử của A là CxHyOzNt.
![]()
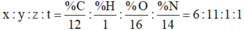

Đúng 0
Bình luận (0)
Hợp chất hữu cơ X gồm 3 nguyên tố C, H, O. Biết trong X, phần trăm khối lượng của carbon,
hydrogen lần lượt là 42,10%; 6,43%.
a. Xác định công thức đơn giản nhất của X.
b. Xác định công thức phân tử của X, biết khối lượng phân tử của X bằng 342 amu.
c. Xác định công thức phân tử của X, biết phân tử khối của X nằm trong khoảng 513 đến 855
Đọc tiếp
Hợp chất hữu cơ X gồm 3 nguyên tố C, H, O. Biết trong X, phần trăm khối lượng của carbon,
hydrogen lần lượt là 42,10%; 6,43%.
a. Xác định công thức đơn giản nhất của X.
b. Xác định công thức phân tử của X, biết khối lượng phân tử của X bằng 342 amu.
c. Xác định công thức phân tử của X, biết phân tử khối của X nằm trong khoảng 513 đến 855
đốt cháy hoàn toàn 12gam hợp chất hữu cơ X thu được 17,6gam CO2 và 7,2gam nước
a, trong X có những nguyên tố nào?
b, xác định công thức phân tử của hợp chất hữu cơ X, biết Mx = 60g/mol
a, - Đốt X thu CO2 và H2O → X chứa C và H, có thể có O.
Ta có: \(n_{CO_2}=\dfrac{17,6}{44}=0,4\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{7,2}{18}=0,4\left(mol\right)\Rightarrow n_H=0,4.2=0,8\left(mol\right)\)
⇒ mC + mH = 0,4.12 + 0,8.1 = 5,6 (g) < 12 (g)
→ X chứa C, H và O.
⇒ mO = 12 - 5,6 = 6,4 (g) \(\Rightarrow n_O=\dfrac{6,4}{16}=0,4\left(mol\right)\)
b, Gọi CTPT của X là CxHyOz.
⇒ x:y:z = 0,4:0,8:0,4 = 1:2:1
→ CTPT của X có dạng (CH2O)n
\(\Rightarrow n=\dfrac{60}{12+1.2+16}=2\)
Vậy: CTPT của X là C2H4O2.
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 3,75 gam một chất hữu cơ A, thu được 11 gam CO2 và 6,75 gam H2O. Biết khối lượng mol của A là 30 gam. Xác định công thức phân tử của A.
a) A hợp chất hữu cơ A gồm những nguyên tố nào ?
b) xác định công thức phân tử của hợp chất hữu cơ A
c) Dẫn toàn bộ khí sinh đi qua bình đựng dung dịch NaOH dư. Tính khối lượng muối tạo thành.
a, có nCO2=11/44=0,25 mol
có nC=nCO2=0,25mol=>mC=12.0,25=3(g)
có nH2O=6,75/18=0,375mol
có nH=2nH2O=2.0,375=0,75mol=>mH=0,75(g)
=>mH+mC=0,75+3=3,75=mA
=> A gồm nguyên tố C và H
b, gọi CTPT A là CxHy
có x/y=nC/nH=0,25/0,75=1/3
=> công thức thực nghiệm (CH3)n<=>CnH3n
có MA=30 gam/mol<=>12n+3n=30<=>n=2
vậy CTPT của A là C2H6
c;PTHH: CO2+2NaOH->Na2CO3+H2O
=> nNa2CO3=nCO2=0,25mol=>mNa2CO3=0,25.106=26,5 gam
Đúng 0
Bình luận (2)
Đốt cháy hoàn toàn 3,2 g hợp chất hữu cơ X thu đc 8,8 g khí \(CO_2\) và 7,2 g \(H_2O\) a, Hợp chất X tạo bởi những nguyên tố hh nào?
b, Xác định công thức phân tử của X. Biết công thức đơn giản của X cũng là công thức phân tử
\(n_C=n_{CO_2}=\dfrac{8.8}{44}=0.2\left(mol\right)\)
\(n_H=2n_{H_2O}=2\cdot\dfrac{7.2}{18}=0.8\left(mol\right)\)
\(m_O=3.2-0.2\cdot12-0.8=0\)
X chứa : C và H
\(CT:C_xH_y\)
\(x:y=0.2:0.8=1:4\)
\(CTPT:CH_4\)
Đúng 3
Bình luận (0)
\(m_{O_2} = 8,8 + 7,2 -3,2 = 12,8(gam) \Rightarrow n_{O_2} = \dfrac{12,8}{32} = 0,4(mol)\\ n_{CO_2} = \dfrac{8,8}{44} = 0,2(mol) ; n_{H_2O} = \dfrac{7,2}{18} = 0,4(mol)\\ \Rightarrow n_{O(trong\ X)} = 0,2.2 + 0,4 - 0,4.2 = 0\)
Vậy X gồm hai nguyên tố : Cacbon và Hidro
\(n_C = n_{CO_2} = 0,2(mol)\\ n_H = 2n_{H_2O} = 0,4.2 = 0,8(mol)\\ n_C : n_H = 0,2 : 0,8 = 1 : 4\)
X là CH4
Đúng 3
Bình luận (0)