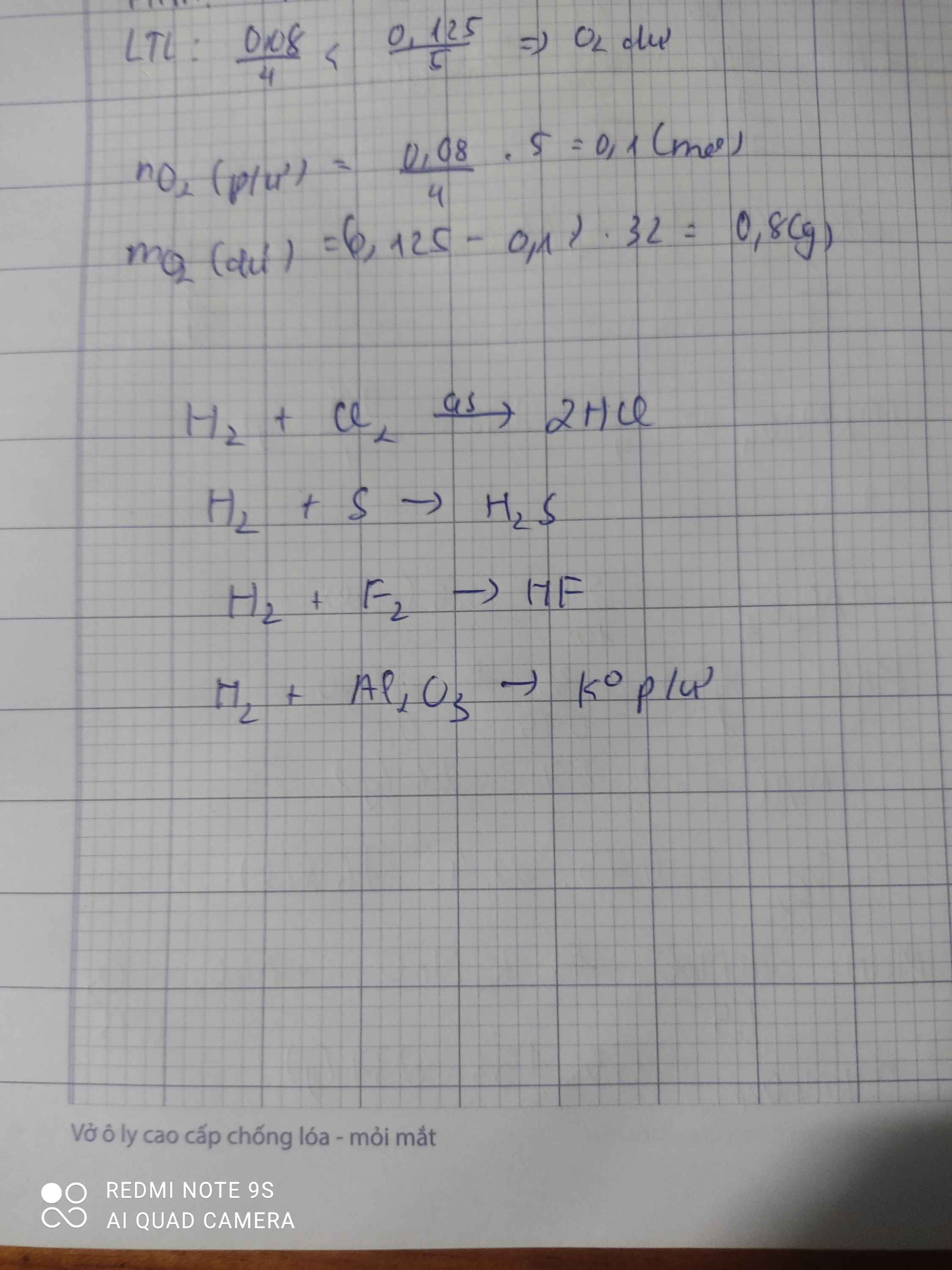9,286g h2 Zu,Cu+h2so4 -> 2,24(l) H2 đk+c % Zn, % Cu

Những câu hỏi liên quan
9,286g h2 Zu,Cu+h2so4 -> 2,24(l) H2 đk+c % Zn, % Cu
a, Fe + H2So4 20% -> d2 A và 1,12 (L) Khí B đk+cmFe, md2 H2so4, C% d2 Acho 10 g hỗn hợp gồm Zn và Cu tác dụng với dung dịch axit H2SO4 loãng thì thu được 2,24 lít H2 ( đktc ). Tính thành phần phần trăm về khối lượng của mỗi kim loại trong hỗn hợp ban đầu ( Biết Cu không tan trong axit H2SO4 loãng )
n H2=2.24/22.4=0.1(mol)
Zn + H2SO4  ZnSO4 + H2
ZnSO4 + H2
0.1 0.1
m Zn=0.1*65=6.5(g)
%Zn=6.5/10*100%=65%
%Cu=100%-65%=35%
Đúng 1
Bình luận (0)
Zn + H2SO4 -> ZnSO4 + H2 (1)
nH2=0,1(mol)
Từ 1:
nZn=nH2=0,1(mol)
mZn=65.0,1=6,5(g)
%mZn=\(\dfrac{6,5}{10}.100\%=65\%\)
%mCu=100-65=35%
Đúng 0
Bình luận (0)
10)KNO3 →11) H2O →12) H2 + O2 →13) H2 + CuO →14) H2 + PbO →15) H2 + MgO →16) H2 + Fe3O4 →17) Al + H2SO4 →18) Cu + H2SO4(l) →19) Zn + HCl →20) Fe + H2SO4 →21) Ag + HCl →22) Ag + O2 →23) P2O5 + H2O →24) SO2 + H2O →25) CO2 + H2O →26) C + H2 →27) H2 + Cl2 →28) H2 + S →29) H2 + F2 →30) H2 + Al2O3 →
Đọc tiếp
10)KNO3 →
11) H2O →
12) H2 + O2 →
13) H2 + CuO →
14) H2 + PbO →
15) H2 + MgO →
16) H2 + Fe3O4 →
17) Al + H2SO4 →
18) Cu + H2SO4(l) →
19) Zn + HCl →
20) Fe + H2SO4 →
21) Ag + HCl →
22) Ag + O2 →
23) P2O5 + H2O →
24) SO2 + H2O →
25) CO2 + H2O →
26) C + H2 →
27) H2 + Cl2 →
28) H2 + S →
29) H2 + F2 →
30) H2 + Al2O3 →
10) \(2KNO_3\underrightarrow{t^o}2KNO_2+O_2\)
11) \(2H_2O\underrightarrow{đp}2H_2+O_2\)
12) \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
13) \(H_2+CuO\underrightarrow{t^o}Cu+H_2O\)
14) \(H_2+PbO\underrightarrow{t^o}Pb+H_2O\)
15) Không pư
16) \(4H_2+Fe_3O_4\underrightarrow{t^o}3Fe+4H_2O\)
17) \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
18) Không pư
19) \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
20) \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
21) Không pư
22) Không pư
23) \(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
24) \(SO_2+H_2O⇌H_2SO_3\)
25) \(CO_2+H_2O⇌H_2CO_3\)
26) \(C+2H_2\underrightarrow{t^o,xt}CH_4\)
27) \(H_2+Cl_2\underrightarrow{as}2HCl\)
28) \(H_2+S\underrightarrow{t^o}H_2S\)
29) \(H_2+F_2\underrightarrow{-252^oC}2HF\)
30) Không pư
Đúng 4
Bình luận (0)
cho 20g hỗn hợp Zn và Cu tác dụng với dung dịch H2SO4 tạo ra 4,48 l H2(đktc)
a.Tính khỗi lượng mỗi kim loại
b.Tính C% H2SO4
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2(mol)\\ Zn+H_2SO_4\to ZnSO_4+H_2\\ \Rightarrow n_{Zn}=0,2(mol)\\\Rightarrow m_{Zn}=0,2.65=13(g)\\ \Rightarrow m_{Cu}=20-13=7(g)\\ b,\text{Đề thiếu}\)
Đúng 1
Bình luận (1)
a)\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH:\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(\Rightarrow n_{Zn}=n_{H_2}=0,2\left(mol\right)\)
Khối lượng Zn là:\(m_{Zn}=0,2.65=13\left(g\right)\)
Khối lượng Cu là: \(m_{Cu}=20-13=7\left(g\right)\)
Đúng 0
Bình luận (0)
\(Zn + H_2SO_4 \rightarrow ZnSO_4 + H_2\)
\(n_{H_2}= \dfrac{4,48}{22,4}= 0,2 mol\)
Theo PTHH:
\(n_{Zn}= n_{H_2}= 0,2 mol\)
\(\Rightarrow m_{Zn}= 0,2 . 65 = 13 g\)
\(m_{Cu}= 20 - 13= 7 g\)
b) Bạn xem lại đề nhé, thiếu m dung dịch axit
Đúng 0
Bình luận (0)
hỗn hợp A gồm Mg,Zn,Cu.
49,8(g) A +H2SO4 loãng dư được 6,72(l) H2 đktc.
49,8(g)A tác dụng đủ với 5,6(l) O2 đktc.
xđ %Cu
Cho 10g hỗn hợp Zn và cu tác dụng với dung dịch axit H2SO4 loãng thì thu được 2,24 lít H2(Đktc). Tính thành phần % về khối lượng của mỗi kim loại trong hỗn hợp ban đầu?
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ n_{Zn}=n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ \%m_{Zn}=\dfrac{0,1.65}{10}.100=65\%\\ \Rightarrow\%m_{Cu}=100\%-65\%=35\%\)
Đúng 0
Bình luận (0)
Zn+H2SO4→ZnSO4+H2nZn=nH2=2,2422,4=0,1(mol)%mZn=0,1.6510.100=65%⇒%mCu=100%−65%=35%
Đúng 0
Bình luận (0)
Cho 10g hỗn hợp gồm Zn và Cu tác dụng với dung dịch axit H2SO4 loãng thì thu được 2,24 lit H2 (đktc). Tính thành phần % về khối lượng của mỗi kim loại trong hỗn hợp ban đầu.
Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Pt : Zn + H2SO4 → ZnSO4 + H2\(|\)
1 1 1 1
0,1 0,1
Số mol của kẽm
nZn = \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
Khối lượng của kẽm
mZn = nZn . MZn
= 0,1 . 65
= 6,5 (g)
Khối lượng của đồng
mCu = 10 - 6,5
= 3,5 (g)
0/0Zn = \(\dfrac{m_{Zn}.100}{m_{hh}}=\dfrac{6,5.100}{10}=65\)0/0
0/0Cu = \(\dfrac{m_{Cu}.100}{m_{hh}}=\dfrac{3,5.100}{10}=35\)0/0
Chúc bạn học tốt
Đúng 0
Bình luận (0)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ PTHH:Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\\ \left(mol\right)....0,1.....0,1...........0,1.....\leftarrow0,1\\ m_{Zn}=0,1.65=6,5\left(g\right)\\ \left\{{}\begin{matrix}\%m_{Zn}=\dfrac{6,5}{10}.100\%=65\%\\\%m_{Cu}=100\%-65\%=35\%\end{matrix}\right.\)
Đúng 0
Bình luận (0)
cho M gam hỗn hợp kim loại Fe,Cu ( đề 2: Al,Cu) tác dụng với Hcl dư thu dc 6,72 lít H2(đktc) vẫn cho mg h2 trên tác dụng với H2So4 đặc nguyên thu dc 2,24 lít So2
a, viết pt pứ / b, tính m
Kim loại X tác dụng với dung dịch
H
2
S
O
4
cho khí
H
2
. Khí
H
2
tác dụng oxit kim loại Y cho kim loại Y khi nung nóng. Cặp kim loại X – Y có thể làA. Zn – CuB. Cu - AgC. Ag - PbD. Cu - Pb
Đọc tiếp
Kim loại X tác dụng với dung dịch H 2 S O 4 cho khí H 2 . Khí H 2 tác dụng oxit kim loại Y cho kim loại Y khi nung nóng. Cặp kim loại X – Y có thể là
A. Zn – Cu
B. Cu - Ag
C. Ag - Pb
D. Cu - Pb