Cho hỗn hợp A gồm Al và CuO phản ứng vừa hết với 36,5 gam acid HCl; sau phản ứng thấy thoát ra 7,437 lít khi ở đkc. Tỉnh % khối lượng mỗi chất trong hỗn hợp A.

Những câu hỏi liên quan
Hỗn hợp X gồm: 0,1 mol Cu; 0,2 mol Al và 0,3 mol Mg.
a) Tính % khối lượng mỗi kim loại trong hỗn hợp X.
b) Tính số gam acid HCl cần dùng để phản ứng vừa hết với hỗn hợp X. Từ đó tính thể tích khi thoát ra (đo ở đkc).
a) \(m_X=0,1\cdot64+0,2\cdot27+0,3\cdot24=19\left(g\right)\)
\(\Rightarrow\%m_{Cu}=\dfrac{0,1\cdot64\cdot100}{19}=34\%\)
\(\Rightarrow\%m_{Al}=\dfrac{0,2\cdot27\cdot100}{19}=28\%\)
\(\Rightarrow\%m_{Mg}=100\%-34\%-28\%=38\%\)
b) \(Cu+2HCl\rightarrow CuCl_2+H_2\) (1)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\) (2)
\(Mg+2HCl\rightarrow MgCl_2+H_2\) (3)
\(n_{HCl\left(1\right)}=2n_{Cu}=2\cdot0,1=0,2\left(mol\right)\)
\(n_{HCl\left(2\right)}=\dfrac{6\cdot n_{Al}}{2}=3\cdot0,2=0,6\left(mol\right)\)
\(n_{HCl\left(3\right)}=2n_{Mg}=2\cdot0,3=0,6\left(mol\right)\)
\(\Rightarrow m_{HCl}=\left(0,2+0,6+0,6\right)\cdot36,5=51,1\left(g\right)\)
\(n_{H_2\left(1\right)}=n_{Cu}=0,1\left(mol\right);n_{H_2\left(2\right)}=\dfrac{3\cdot0,2}{2}=0,3\left(mol\right);n_{H_2\left(3\right)}=n_{Mg}=0,3\left(mol\right)\)
\(V_{H_2\left(dkc\right)}=\left(0,1+0,3+0,3\right)\cdot24,79=17,353\left(l\right)\)
Đúng 1
Bình luận (1)
Cho 1,288 gam hỗn hợp X gồm Ca, Al và Mg phản ứng hết với O2 dư thu được 2,344 gam hỗn hợp Y gồm 3 oxit. Cho Y phản ứng vừa đủ với V lít dung dịch HCl 1M. Giá trị của V là A. 0,066 B. 0,132 C. 0,033 D. 0,198
Đọc tiếp
Cho 1,288 gam hỗn hợp X gồm Ca, Al và Mg phản ứng hết với O2 dư thu được 2,344 gam hỗn hợp Y gồm 3 oxit. Cho Y phản ứng vừa đủ với V lít dung dịch HCl 1M. Giá trị của V là
A. 0,066
B. 0,132
C. 0,033
D. 0,198
X +O2 → Y => Bảo toàn khối lượng => nO2 = 0,033 mol
Khi Y phản ứng với HCl thực chất là thay thế 1 mol O bằng 2 mol Cl theo bảo toàn điện tích
=> n HCl = 2n O = 4nO2 = 0,132 mol=>V= 0,132 l
=>B
Đúng 0
Bình luận (0)
Cho 2,7 gam hỗn hợp X gồm Al, Fe và Mg phản ứng hết với O2 dư thu được 4,14 gam hỗn hợp Y gồm 3 oxit. Cho Y phản ứng vừa đủ với V lít dung dịch HCl 0,3M. Giá trị của V là A. 0,30 B. 0,15 C. 0,60 D. 0,12
Đọc tiếp
Cho 2,7 gam hỗn hợp X gồm Al, Fe và Mg phản ứng hết với O2 dư thu được 4,14 gam hỗn hợp Y gồm 3 oxit. Cho Y phản ứng vừa đủ với V lít dung dịch HCl 0,3M. Giá trị của V là
A. 0,30
B. 0,15
C. 0,60
D. 0,12
Đáp án : C
Bảo toàn khối lượng :
mKL + m O 2 = mY
=> n O 2 = 0,045 mol
Tổng quát cả quá trình :
O + 2H -> H2O
=> nHCl = 4 n O 2 = 0,18 mol
=> Vdd HCl = 0,6 lit
Đúng 0
Bình luận (0)
nung hỗn hợp bột gồm 38,4 gam CuO và m gam Al ở nhiệt độ cao. Sau khi phản ứng hoàn toàn thu được 44,88 gam hỗn hợp chất rắn X. Cho X tác dụng với dung dịch HCl dư thì thấy HCl phản ứng hết a mol. GIá trị a là
AI LÀM XONG VÀ TRÌNH BÀY ĐẦY ĐỦ NHÂT SẼ ĐƯỢC NHIỀU TICK
\(n_{Al}=\dfrac{44,88-38,4}{27}=0,24\left(mol\right)\)
\(n_{CuO}=\dfrac{38,4}{80}=0,48\left(mol\right)\)
PTHH: 3CuO + 2Al --to--> 3Cu + Al2O3
Xét tỉ lệ: \(\dfrac{0,48}{3}>\dfrac{0,24}{2}\) => CuO dư, Al hết
PTHH: 3CuO + 2Al --to--> 3Cu + Al2O3
0,36<--0,24-------------->0,12
=> \(\left\{{}\begin{matrix}n_{Al_2O_3}=0,12\left(mol\right)\\n_{CuO\left(dư\right)}=0,12\left(mol\right)\end{matrix}\right.\)
PTHH: Al2O3 + 6HCl --> 2AlCl3 + 3H2O
0,12-->0,72
CuO + 2HCl --> CuCl2 + H2O
0,12-->0,24
=> nHCl = 0,72 + 0,24 = 0,96 (mol)
Đúng 4
Bình luận (0)
1) cho 13,4 g hỗn hợp X gồm:Mg,Fe,Al phản ứng vừa đủ với dung dịch có chứa 36,5 g HCL,mgam hỗn hợp với muối.Y gồm :Alcl3 ,Mgcl2 ,Fecl2 .Tính m
nHCl = 1 (mol)
Mg + 2HCl ---> MgCl2 + H2
Fe + 2HCl ---> FeCl2 + H2
2Al + 6HCl ---> 2AlCl3 + 3H2
Theo PTHH, ta thấy: \(n_{H_2}=\dfrac{1}{2}.n_{HCl}=\dfrac{1}{2}.1=0,5\left(mol\right)\)
\(\Rightarrow m_{H_2}=0,5.2=1\left(g\right)\)
Bảo toàn khối lượng => m = 13,4 + 36,5 - 1 = 48,9 (g)
Đúng 0
Bình luận (0)
nHCl = 1 (mol)
Mg + 2HCl ---> MgCl2 + H2
Fe + 2HCl ---> FeCl2 + H2
2Al + 6HCl ---> 2AlCl3 + 3H2
Theo PTHH, ta thấy: nH2=12.nHCl=12.1=0,5(mol)nH2=12.nHCl=12.1=0,5(mol)
⇒mH2=0,5.2=1(g)⇒mH2=0,5.2=1(g)
Bảo toàn khối lượng => m = 13,4 + 36,5 - 1 = 48,9 (g)![]()
Đúng 0
Bình luận (0)
Cho 3,68 gam hỗn hợp X gồm Al, Fe và Mg phản ứng hết với O2 dư, thu được 5,6 gam hỗn hợp Y gồm 3 oxit. Cho Y phản ứng vừa đủ với V lít dung dịch HCl 0,5M. Giá trị của V là
A.0,67.
B.0,48.
C.0,25.
D.0,69.
Bảo toàn KL: \(m_{O_2}=m_Y-m_X=5,6-3,68=1,92(g)\)
\(\Rightarrow n_{O_2}=\dfrac{1,92}{32}=0,06(mol)\\ \Rightarrow n_{O(O_2)}=0,12(mol)\\ \Rightarrow n_{oxit}=n_{O(O_2)}=0,012(mol)\\ \Rightarrow n_{H^+}=n_{HCl}=2n_{O(oxit)}=0,24(mol)\\ \Rightarrow V=\dfrac{0,24}{0,5}=0,48(l)\)
Chọn B
Đúng 1
Bình luận (0)
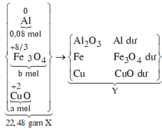
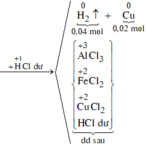
Nung 22,48 gam hỗn hợp X gồm Fe3O4, CuO và Al một thời gian, thu được hỗn hợp Y. Cho Y vào dung dịch HCl dư, thu được 0,896 lít khí (đktc) và 1,28 gam chất rắn Z. Mặt khác, Y phản ứng vừa đủ với 800ml dung dịch NaOH 1M. Phần trăm khối lượng CuO trong X là:
A. 28,47%.
B. 61,92%.
C. 9,61%.
D. 36,35%.
*Xét giai đoạn Y tác dụng với dung dịch NaOH:
Số mol NaOH là: ![]()
Sơ đồ phản ứng:
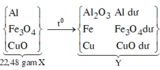
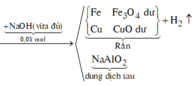
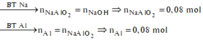
*Xét giai đoạn Y tác dụng với dung dịch HCl dư
Số mol H2 thu được là: ![]()
Chất rắn Z là Cu ![]()
Chất rắn Z là Cu => Dung dịch sau không chứa F e 3 +
Sơ đồ phản ứng:
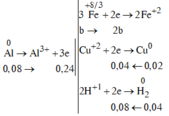
![]() => b = 0,06 mol
=> b = 0,06 mol
![]()
![]()
![]()
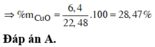
Đúng 0
Bình luận (0)
Cho 35, 5 gam hỗn hợp A gồm kẽm và sắt (III) oxit tác dụng hết với HCl thu được 6,72 lít khí ở đktc a) Tính khối lượng HCl tham gia phản ứngb) Khí sinh ra phản ứng vừa đủ với 19,6 g hỗn hợp B gồm CuO và Fe3O4 nung nóng. Xác định khối lượng các chất có trong chất rắn sau phản ứng
a)
\(Zn + 2HCl \to ZnCl_2 + H_2\\ Fe_2O_3 + 6HCl \to 2FeCl_3 + 3H_2\)
Theo PTHH : \(n_{Zn} = n_{H_2} = \dfrac{6,72}{22,4} = 0,3(mol)\)
\(\Rightarrow n_{Fe_2O_3} = \dfrac{35,5-0,3.65}{160} = 0,1\\ \Rightarrow n_{HCl} = 2n_{Zn} + 6n_{Fe_2O_3} = 0,3.2 + 0,1.6 = 1,2(mol)\\ \Rightarrow m_{HCl} = 1,2.36,5 = 43,8(gam)\)
b)
\(CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\ Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O\)
Gọi \(n_{CuO} = a;n_{Fe_2O_3} = b\)
\(\left\{{}\begin{matrix}80a+160b=19,6\\a+3b=0,3\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,135\\b=0,055\end{matrix}\right.\)
Vậy :
\(\left\{{}\begin{matrix}n_{Cu}=0,135\\n_{Fe}=0,055.2=0,11\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}m_{Cu}=0,135.64=8,64\left(gam\right)\\m_{Fe}=0,11.56=6,16\left(gam\right)\end{matrix}\right.\)
Đúng 5
Bình luận (1)
Cho m gam hỗn hợp gồm Mg, Al và Zn phản ứng vừa đủ với 7,84 lít (đktc) khí Cl2. Cũng m gam hỗn hợp trên phản ứng vừa đủ với m1 gam dung dịch HCl 14,6%. Giá trị của m1 là A. 87,5 B. 175,0 C. 180,0 D. 120,0
Đọc tiếp
Cho m gam hỗn hợp gồm Mg, Al và Zn phản ứng vừa đủ với 7,84 lít (đktc) khí Cl2. Cũng m gam hỗn hợp trên phản ứng vừa đủ với m1 gam dung dịch HCl 14,6%. Giá trị của m1 là
A. 87,5
B. 175,0
C. 180,0
D. 120,0
Đáp án B
Khi phản ứng với Cl2
n C l 2 = 7 , 84 22 , 4 = 0 , 35 ( m o l )
X – ne → X +n Cl2+ 2e→ 2Cl-
ne (KL nhường) = ne ( Cl2 nhận ) = 0,35.2 = 0,7 (mol)
Khi phản ứng với HCl
X – ne → X +n 2H+ + 2e → H2
ne( H+ nhận ) = ne (KL nhường) = 0,7 (mol)
=> nH+ = 0,7 (mol)
=> mHCl = 0,7.36,5 = 25,55 (g)
m d d H C l = m H C l . 100 % C % = 25 , 55 . 100 % 14 , 6 % = 175 ( g )
Đúng 0
Bình luận (0)

















