Cho 32.5g kẽm vào dd có chứa 5.64g Cu(NO3)2 và 3.4g AgNO3 ( phản ứng hoàn toàn) , kim loại sinh ra bám vào kim loại ban đầu . Tính khối lượng sau cùng của thanh kim loại kẽm?

Những câu hỏi liên quan
Cho 32.5g kẽm vào dd có chứa 5.64g Cu(NO3)2 và 3.4g AgNO3 ( phản ứng hoàn toàn) , kim loại sinh ra bám vào kim loại ban đầu . Tính khối lượng sau cùng của thanh kim loại kẽm?
Tính ra số mol hết, viết phương trình, kim loại sinh ra bám vào kim loại ban đầu là Ag bám Cu nên đẩy số mol của cái muối đó sang Cu, Ag. m spu = mbđ - mCu - mAg ăn bám
--- tui đoán rứa :v
Đúng 1
Bình luận (27)
Các PTHH xảy ra:
\(Zn+Cu\left(NO_3\right)_2-->Zn\left(NO_3\right)_2+Cu\)
0,03<--0,03--------------------------------->0,03 (mol )
\(Zn+2AgNO_3-->Zn\left(NO_3\right)_2+2Ag\)
0,01<---0,02------------------------------->0,02 ( mol )
Ta có \(n_{Cu\left(NO_3\right)_2}=\dfrac{5,64}{188}=0,03mol\);\(n_{AgNO_3}=\dfrac{3,4}{170}=0,02mol\)
Khối lượng sau cùng của thanh kim loại kẽm
=KL kẽm bđ + mCu+mAg-mZn[phản-ứng]
=32,5+0,03.64+0,02.108-0,04.65=33,98gam
Vậy khối lượng thanh kim loại kẽm sau cùng là 33,98gam.
Đúng 0
Bình luận (0)
Ta có: \(\left\{{}\begin{matrix}n_{Zn}=0,5\left(mol\right)\\n_{Cu\left(NO_3\right)_2}=0,03\left(mol\right)\\n_{AgNO_3}=0,02\left(mol\right)\end{matrix}\right.\) \(Zn\left(0,01\right)+2AgNO_3\left(0,02\right)\rightarrow Zn\left(NO_3\right)_2+2Ag\left(0,02\right)\)\(\left(1\right)\) \(Zn\left(0,03\right)+Cu\left(NO_3\right)_2\left(0,03\right)\rightarrow Zn\left(NO_3\right)_2+Cu\left(0,03\right)\)\(\left(2\right)\) \(*Phản.ứng.(1):\)Ta có: \(\left\{{}\begin{matrix}m_{Ag}\left(tao\right)=0,02.108=2,16\left(g\right)\\m_{Zn}\left(tan\right)=0,01.65=0,65\left(g\right)\end{matrix}\right.\) \(\Rightarrow\) Khối lượng thanh Kẽm ở phản ứng 1 tăng: \(2,16-0,65=1,51\left(g\right)\)\(\left(II\right)\) \(*Phản.ứng.(2):\)Ta có: \(\left\{{}\begin{matrix}m_{Cu}\left(tao\right)=0,03.64=1,92\left(g\right)\\m_{Zn}\left(tan\right)=0,03.65=1,95\left(g\right)\end{matrix}\right.\) \(\Rightarrow\)Khối lượng thanh Kẽm ở phản ứng 1 giảm: \(1,95-1,92=0,03\left(g\right)\)\(\left(III\right)\) Từ (I ), (II) và (III) \(\Rightarrow\)Khối lượng tham Kẽm khi kết thúc phản ứng là: \(32,5+1,51-0,03=33,98\left(g\right)\)
Đúng 0
Bình luận (1)
Nhúng 2 thanh Zn , mỗi thanh có khối lượng 100g vào 2dd muối Cu(NO3 )2 và X(NO3)2 ( X là kim loại chưa biết) Sau một thời gian lấy hai thanh kẽm ra khỏi hai dd , đem rửa sach làm khô cân lại . Kết quả cho thấy một thanh có khối lượng 99,75g , thanh kia có khối lượng 130, 50g . Biết rằng lương kẽm tham gia phản ứng ở hai dưng dịch là như nhau .a) giải thích về sự tăng giảm khối lượng ở 2thanh kẽm nói trên b ) Xác định kim loại X .
Đọc tiếp
Nhúng 2 thanh Zn , mỗi thanh có khối lượng 100g vào 2dd muối Cu(NO3 )2 và X(NO3)2 ( X là kim loại chưa biết) Sau một thời gian lấy hai thanh kẽm ra khỏi hai dd , đem rửa sach làm khô cân lại . Kết quả cho thấy một thanh có khối lượng 99,75g , thanh kia có khối lượng 130, 50g . Biết rằng lương kẽm tham gia phản ứng ở hai dưng dịch là như nhau .
a) giải thích về sự tăng giảm khối lượng ở 2thanh kẽm nói trên
b ) Xác định kim loại X .
sự giảm kl là do Zn đã đẩy Cu ra khỏi dd muối nên lượng Cu bị đẩy đã thế chỗ lương Zn tgpu mà Cu có ntk nhẹ hơnZn nên kl thanh kim loại mới giảm
b, chắc là Ba
Đúng 0
Bình luận (3)
Lấy hai thanh kim loại M đều có giá trị là 1g. Nhúng thanh thứ nhất vào dung dịch AgNO3 và thanh thứ hai vào dung dịch Cu(NO3)2. Sau một thời gian khối lượng thanh thứ nhất tăng 151%, thanh thứ hai giảm 1% (so với ban đầu). Biết rằng số mol M phản ứng ở hia thanh là như nhau. Vậy M là: A. Cd B. Fe C. Zn D. Cu
Đọc tiếp
Lấy hai thanh kim loại M đều có giá trị là 1g. Nhúng thanh thứ nhất vào dung dịch AgNO3 và thanh thứ hai vào dung dịch Cu(NO3)2. Sau một thời gian khối lượng thanh thứ nhất tăng 151%, thanh thứ hai giảm 1% (so với ban đầu). Biết rằng số mol M phản ứng ở hia thanh là như nhau. Vậy M là:
A. Cd
B. Fe
C. Zn
D. Cu
Đáp án C
Phương trình phản ứng:
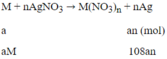
Khối lượng thanh thứ nhất tăng 151%:
108an - aM = 1,51 (1)

Khối lượng thanh thứ 2 giảm:
aM - 32an = 0,01 (2)
Tổ hợp (1) và (2) ta được: aM = 0,65; an = 0,02
⇒ Chọn M = 32,5n
Khi n = 2 thì M = 65
Vậy M =Zn
Đúng 0
Bình luận (0)
Cho 6g hỗn hợp mg và cu vào dd axít clohiđric phản ứng sảy ra vừa đủ.Sau phản ứng người ta thu đc 4,48l khí (ở đktc).Tính khối lượng của mỗi kim loại trong hỗn hợp trên
Vì Cu không tác dụng với dung dịch axit clohidric loãng :
\(n_{H2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
0,2 0,2
\(n_{Mg}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(m_{Mg}=0,2.24=4,8\left(g\right)\)
\(m_{Cu}=6-4,8=1,2\left(g\right)\)
Chúc bạn học tốt
Đúng 3
Bình luận (0)
Lấy hai thanh kim loại M đều có giá trị là 1g. Nhúng thanh thứ nhất vào dung dịch AgNO3 và thanh thứ hai vào dung dịch Cu(NO3)2. Sau một thời gian khối lượng thanh thứ nhất tăng 151%, thanh thứ hia giảm 1% (so với ban đầu). Biết rằng số mol M phản ứng ở hia thanh là như nhau. Vậy M là kim loại gi?
hoà tan hoàn toàn 3,28g hỗn hợp kim loại trong hỗn hợp kim loại gồm cu, fe vào dung dịch h2so4 đặc nóng dư thu được 1,568l khí so2 và hai muối sunfat tính khối lượng dung dịch của h2so4 98% đã dùng
n SO2 = 1,568/22,4 = 0,07(mol)
Trong bài toán kim loại tác dụng với H2SO4, ta luôn có :
n H2SO4 pư = 2n SO2 = 0,07.2 = 0,14(mol)
=> m dd H2SO4 = 0,14.98/98% = 14(gam)
Đúng 2
Bình luận (0)
Có một hon hợp gom ba kim loại la cu mg al có khối lượng là 10 ga) người ta cho hh kim loại nay tác dụng với de hcm dư ,sau đó lọc lấy phần không tan riêng ra , rửa sạch đem nung nóng trong không khí cho đến khi phan ứng hoàn toàn ,sản phẩm thu được khối lượng là 8 gb) cho thêm dd natrihidroxit vào phần nước lọc cho đến dư .Lọc lấy kết tua rửa sạch ,đem nung nóng ở nhiệt độ cao ,sản phẩm thu được có khối lượng 4 gam1 hay viết các phương t...
Đọc tiếp
Có một hon hợp gom ba kim loại la cu mg al có khối lượng là 10 g
a) người ta cho hh kim loại nay tác dụng với de hcm dư ,sau đó lọc lấy phần không tan riêng ra , rửa sạch đem nung nóng trong không khí cho đến khi phan ứng hoàn toàn ,sản phẩm thu được khối lượng là 8 g
b) cho thêm dd natrihidroxit vào phần nước lọc cho đến dư .Lọc lấy kết tua rửa sạch ,đem nung nóng ở nhiệt độ cao ,sản phẩm thu được có khối lượng 4 gam
1 hay viết các phương trình hóa học
2 Tính thành phần% về khối lượng mỗi kim loại
Mg + 2HCl = MgCl2 +H2
x x
2Al + 6HCl= 2AlCl3 + 3H2
y y
2Cu + O2 = 2CuO
z z = 8/80 = 0,1 mol
3NaOH + AlCl3 = Al(OH)3 + 3NaCL
y y
Al(OH)3 + NaOH = NaALO2 + 2H2O
y y
2NaOH + MgCl2 = Mg(OH)2 + 2NaCl
x x
Mg(OH)2 = MgO + H2O
x x = 4/40 = 0,1 mol
=>mCu= 0,1*64=6,4
mMg=0,1*24=2,4
mAl=10-6,4-2,4=1,2
Đúng 0
Bình luận (0)
cho a gam Fe vào 500 ml dung dịch hỗn hợp gồm Hcl 1,8M và Cu(NO3)2 0,2M . Sau khi các phản ứng xảy ra hoàn toàn thu được 0,5 gam hỗn hợp kim loại và khí NO( sản phẩm khử duy nhất ). Giá trị của a là?
\(n_{Cu\left(NO_3\right)_2}=0,5.0,2=0,1\left(mol\right)\)
\(n_{NO_3^-}=0,1.2=0,2\left(mol\right)\)
\(n_{Cu^{2+}}=0,1\left(mol\right)\)
\(n_{HCl}=n_{H^+}=0,5.1,8=0,9\left(mol\right)\)
\(n_{NO}=\dfrac{n_{H^+}}{4}=\dfrac{0,9}{4}=0,225\left(mol\right)\)
Sau phản ứng thu được hỗn hợp kim loại \(\Rightarrow\) Cu và Fe \(\Rightarrow\) \(Fe^{2+}\)
Bảo toàn e:
\(2n_{Fe.pứ}=3n_{NO}+2n_{Cu^{2+}}\)
\(\Rightarrow n_{Fe.pứ}=0,4375\left(mol\right)\)
Có: \(a-m_{Fe.pứ}+m_{Cu}=m_{hh.kl}=0,5\)
\(\Leftrightarrow a-0,4375.56+64.0,1=0,5\\ \Rightarrow a=18,6\)
Đúng 1
Bình luận (0)
Cho 19,5 gam kẽm tác dụng với axit sunfuric. Hãy:
a) Viết PTHH của phản ứng
b) Tính khối lượng axit sunfuric tham gia phản ứng và thể tích của khí hidro sinh ra (đktc)
c) Cho toàn bộ khí hidro sinh ra ở phản ứng trên khử đồng (2) oxit. Hãy tính khối lượng đồng kim loại thu được


























