Tính toán và pha chế các dung dịch sau 500ml dd natri clorua có nồng độ 0,4 M

Những câu hỏi liên quan
Tính toán và pha chế các dd sau 500 ml dd natri clorua có nồng độ 0,4 M
\(n_{NaCl}=0,5.0,4=0,2\left(mol\right)\Rightarrow m_{NaCl}=58,5.0,2=11,7\left(g\right)\\ V_{H_2O}=V_{ddNaCl}=500\left(ml\right)=0,5\left(l\right)\)
Pha chế: Đong 500ml H2O và cân 11,7 gam NaCl, sau đó đổ nước vào bình có chứa 11,7gam NaCl. Tiến hình hoà tan NaCl đến khi NaCl tan hết ta được 500ml dung dịch Natri Clorua có nồng độ 0,4M.
Đúng 2
Bình luận (0)
Hãy tính toán và pha chế các dung dịch sau: 1) 50g dung dịch đường có nồng độ 15%. 2) 100ml dung dịch natri clorua có nồng độ 0,2M. 3) 50g dung dịch đường 5% từ dung dịch đường có nồng độ 15% trở nên. 4) 50m dung dịch natri clorua có nồng độ 0,1M từ dung dịch natri clorua có nồng độ 0,2M ở trên.
Đọc tiếp
Hãy tính toán và pha chế các dung dịch sau:
1) 50g dung dịch đường có nồng độ 15%.
2) 100ml dung dịch natri clorua có nồng độ 0,2M.
3) 50g dung dịch đường 5% từ dung dịch đường có nồng độ 15% trở nên.
4) 50m dung dịch natri clorua có nồng độ 0,1M từ dung dịch natri clorua có nồng độ 0,2M ở trên.
1) Thực hành 1
Phần tính toán
Khối lượng chất tan (đường) cần dùng là:
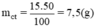
Khối lượng nước cần dùng là: 50 - 7,5 = 42,5(g).
Phần thực hành:
Cần 7,5g đường khan cho vào cốc có dung tích 100ml, khuấy đều với 42,5g nước, được 50g dung dịch đường 15%.
2) Thực hành 2
Phần tính toán
Số mol NaCl cần dùng là:
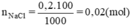
Có khối lượng là: 58,5 x 0,02 = 1,17(g).
Phần thực hành:
Cho 1,17g NaCl khan cho vào cốc chia độ. Rót từ từ nước vào cốc và khuấy đều đến cho vạch 100ml, được 100ml dung dịch NaCl 0,2M.
3) Thực hành 3
Phần tính toán
Khối lượng chất tan(đường) có trong 50g dung dịch đường 5% là:
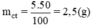
Khối lượng dung dịch đường 15% có chứa 2,5g đường là:
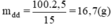
Khối lượng nước cần dùng là: 50 - 16,7 = 33,3(g).
Phần thực hành:
Cần 16,7g dung dịch đường 15% cho vào cốc có dung tích 100ml.Thêm 33,3g nước (hoặc 33,3ml) vào cốc, khuấy đều, được 50g dung dịch đường 5%.
4) Thực hành 4
Phần tính toán
Số mol chất tan (NaCl) có trong 50ml dung dịch 0,1M cần pha chế là:
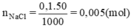
Thể tích dung dịch NaCl 0,2M trong đó có chứa 0,005mol NaCl là:
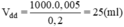
Phần thực hành:
Đong 25ml dung dịch NaCl 0,2M cho vào cốc chia độ. Rót từ từ nước vào cốc đến vạch 50ml. Khuấy đều, được 50ml dung dịch NaCl 0,1M.
Đúng 0
Bình luận (0)
Tính toán và pha chế các dd sau 300g dd đường có nồng độ 25%
\(m_{đường}=300.25\%=75\left(g\right)\\ \Rightarrow m_{H_2O}=300-75=225\left(g\right)\\ \Rightarrow V_{H_2O}=\dfrac{225}{1}=225\left(ml\right)\)
Cách pha chế: Lấy 75 gam đường và đong 225ml nước, sau đó khuấy đều cho đến khi đường tan hoàn toàn ta được 300g dung dịch đường nồng độ 25%
Đúng 2
Bình luận (0)
Tính khối lượng chất tan cần dùng để pha chế các dung dịch sau:
b. 500ml dung dịch HNO3 nồng độ 0,2M.
d. 200ml dung dịch NaNO3 nồng độ 0,2M.
b, \(n_{HNO_3}=0,5.0,2=0,1\left(mol\right)\)
\(\Rightarrow m_{HNO_3}=0,1.63=6,3\left(g\right)\)
d, \(n_{NaNO_3}=0,2.0,2=0,04\left(mol\right)\)
\(\Rightarrow m_{NaNO_3}=0,04.85=3,4\left(g\right)\)
Đúng 1
Bình luận (0)
Hãy tính toán và nêu cách pha chế a) 50ml dd CuSO4 0,4 M từ dung dịch CuSO4 2M b) 50g dd NaCl 2,5 % từ dd NaCl 10 %
a) n CuSO4 =0,4.0,05 = 0,02(mol)
=> V dd CuSO4 = 0,02/2 = 0,01(lít) = 10(ml)
=> V H2O thêm vào = 50 - 10 = 40(ml)
Pha chế : Đong lấy 40 ml nước cất cho vào 10 ml dung dịch CuSO4 2M, khuấy đều
b)
m NaCl = 50.2,5% = 1,25(gam)
m dd NaCl 10% = 1,25/10% = 12,5(gam)
=> m H2O cần thêm = 50 - 12,5 = 37,5 gam
- Cân lấy 12,5 gam dd NaCl 10%
- Đong lấy 37,5 gam nước cho vào cốc, khuấy đều.
Đúng 2
Bình luận (0)
bài toán tính nồng độ%
a) tính nồng độ phần trăm của dung dịch natri clorua khi hòa tan 20 gam muối natri clorua vào 180 gam nước
b) hòa tan 16 gam CuSO4 vào nước thu được dung dịch Cu SO4 20%. Hãy tính khối lượng dung dịch thu được và khối lượng nước cần dùng ?
a)
Khối lượng của dung dịch:
\(m_{dd}=m_{ct}+m_{dm}=20+180=200\left(g\right)\)
Nồng độ phần trăm của dung dịch:
\(C\%=\dfrac{m_{ct}}{m_{dd}}.100\%=\dfrac{20}{200}.100\%=10\%\)
b) đề sai nha bạn
Đúng 1
Bình luận (0)
Có nước cất và những dụng cụ cần thiết, hãy tính toán và giới thiệu cách pha chế. a. 100ml dung dịch MgSO4 0,4M từ dd MgSO4 2M NaCI b,150g dd 2,5% từ dd NaCI 10% b. 50ml dd NaCl có nồng độ 2M.
\(n_{MgSO_4}=\dfrac{0,4.100}{1000}=0,04\left(mol\right)\\
V_{ml}=\dfrac{1000.0,04}{2}=20\left(ml\right)\)
 \(m_{NaCl}=\dfrac{2,5.150}{100}=3,75\left(g\right)\\
m_{\text{dd}}=\dfrac{100.3,75}{10}=37,5\left(g\right)\\
m_{H_2O}=150=37,5=112,5\left(g\right)\)
\(m_{NaCl}=\dfrac{2,5.150}{100}=3,75\left(g\right)\\
m_{\text{dd}}=\dfrac{100.3,75}{10}=37,5\left(g\right)\\
m_{H_2O}=150=37,5=112,5\left(g\right)\)

\(n_{NaCl}=0,05.2=0,1\left(mol\right)\\ m_{NaCl}=0,1.58,5=5,85\left(g\right)\)
cân lấy 5,85 g NaCl cho vào cốc thủy tính có dung tích 100ml ,đổ dần dần nước cất vào cốc và khuấy nhẹ cho đủ 50ml dd
 \(m_{NaCl}=\dfrac{2,5.150}{100}=3,75\left(g\right)\\
m_{\text{dd}}=\dfrac{100.3,75}{10}=37,5\left(g\right)\\
m_{H_2O}=150=37,5=112,5\left(g\right)\)
\(m_{NaCl}=\dfrac{2,5.150}{100}=3,75\left(g\right)\\
m_{\text{dd}}=\dfrac{100.3,75}{10}=37,5\left(g\right)\\
m_{H_2O}=150=37,5=112,5\left(g\right)\)
\(n_{NaCl}=0,05.2=0,1\left(mol\right)\\ m_{NaCl}=0,1.58,5=5,85\left(g\right)\)
cân lấy 5,85 g NaCl cho vào cốc thủy tính có dung tích 100ml ,đổ dần dần nước cất vào cốc và khuấy nhẹ cho đủ 50ml dd
Đúng 0
Bình luận (0)
Cho 200 gam dd NaOH tác dụng hoàn toàn với 200 gam dd Axit Clohidric 7,3% sau phản ứng thu được dd muối Natri Clorua và nước.
a/ Tính nồng độ phần trăm dung dịch NaOH cần dùng.
b/ Tính nồng độ phần trăm dd muối tạo thành sau PƯ.
(Na= 23; Cl= 35,5; H= 1)
a)mH2SO4=\(\dfrac{200.7,3\text{%}}{100\%}\)=14,6g
nHCl=\(\dfrac{14,6}{36,5}\)=0,4(mol)
PTHH:
NaOH+ HCl→ NaCl+ H2O
1 1 1 1
0,4 0,4 0,4 (mol)
⇒mNaOH=0,4.40=16(g)
Nồng độ % của dd NaOH cần dùng là:
C%NaOH=\(\dfrac{16}{200}\) .100%=8%
b)Ta có:mdd spứ=mdd trc pứ=400g
mNaCl=0,4.58,5=23,4g
Nồng độ % dd muối tạo thành sau pứ là:
C%dd NaCl=\(\dfrac{23,4}{400}\) .100%=5,85%
Đúng 1
Bình luận (0)
Cho các dung dịch có cùng nồng độ mol/L sau: (a) amoni clorua, (b) phenylamoni clorua, (c) metylamoni clorua, (d) natri clorua. Dung dịch có pH nhỏ nhất và lớn nhất tương ứng là A. (a) và (b). B. (c) và (d). C. (a) và (c). D. (b) và (d).
Đọc tiếp
Cho các dung dịch có cùng nồng độ mol/L sau: (a) amoni clorua, (b) phenylamoni clorua, (c) metylamoni clorua, (d) natri clorua. Dung dịch có pH nhỏ nhất và lớn nhất tương ứng là
A. (a) và (b).
B. (c) và (d).
C. (a) và (c).
D. (b) và (d).
Chọn D
dùng thuyết axit – bazơ của Bronsted – Lowry, xét phản ứng:
axit – H+ → bazơ liên hợp , bazơ + H+ → axit liên hợp.
➤ quan hệ giữa axit và bazơ liên hợp; bazơ và axit liên hợp là quan hệ bấp bênh:
axit càng mạnh thì bazơ liên hợp càng yếu và ngược lại.
Theo đó, lực bazơ tăng dần như ta biết: C6H5NH2 < NH3 < CH3NH2 < NaOH
⇒ các axit liên hợp có tính axit giảm dần: C6H5NH3+ > NH4+ > CH3NH3+ > Na+
⇒ tính axit của cùng muối clorua (Cl–) của các gốc axit liên hợp trên giảm dần theo thứ tự
tương ứng là: C6H5NH3Cl > NH4Cl > CH3NH3Cl > NaCl.
thêm nữa, pH càng nhỏ thì tương ứng với lực axit càng lớn nên từ thứ tự lực axit trên
⇒ pH tăng dần theo thứ tự: C6H5NH3Cl < NH4Cl < CH3NH3Cl < NaCl.
⇒ dung dịch có giá trị pH nhỏ nhất là (b) và lớn nhất là (d)
Đúng 0
Bình luận (0)


















