Nêu tính chất hóa học của Cacbon đioxit và cho ví dụ
nêu tính chất hóa học của silic đioxit và cho ví dụ
Tham khảo:
Tính chất của SiO2:
SiO2 là oxit axit. Ở nhiệt độ cao, tác dụng với kiềm và oxit bazơ tạo thành muối silicat. Silic đioxit không phản ứng với nước.
Ví dụ:
SiO2 + 2NaOH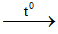 H2O + Na2SiO3 (natri silicat)
H2O + Na2SiO3 (natri silicat)SiO2 + CaO 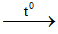
nêu tính chất hóa học của silic đioxit ,cho ví dụ về từng tính chất
Câu 1: lấy 2 ví dụ về hỗn hợp, 2 vd về chất tinh khiết?
phân biệt hốn hợp và chất tinh khiết?
Câu 2:Nguyên tử là gì? nêu cấu tạo của nguyên tử?
Câu 3: Nguyên tố hóa học là gì? Nguyên tử khối là gì?
Câu 4: lấy 2 ví dụ về đơn chất? 2 ví dụ về hợp chất? phân biệt giữa đơn chất và hợp chất?
Câu 5: Nếu ý nghĩa của công thức hóa học SO2 ( lưu huỳnh đioxit )
Câu 6: a, phát biểu quy tắc hóa trị?
b, tính hóa trị của Fe trong Fe2O3. lập công thức hóa học của Mg(II), và NO3(I). Tính phân tử khối
Câu 7: phân biệt hiện tượng vật lí và hiện tượng hóa học rồi lấy vd
Giups với mai nọp rồi, cám ơn ạ
Câu 1. Nêu tính chất hóa học của AXIT. Mỗi tính chất lấy 2 ví dụ minh họa
Câu 2. Nêu tính chất hóa học của BAZO. Mỗi tính chất lấy 2 ví dụ minh họa
Câu 3. Tính nồng độ phần trăm của 250g dung dịch có chứa 25g muối ăn.
Câu 4. Tính nồng độ mol của 200ml dung dịch có 9,8g axit sunfuric
Câu 5. Cho 5,6g sắt vào 100ml dung dịch HCl. Tính thể tích khí sinh ra. Tính nồng độ dung dịch HCl đã dùng.
Câu 6. Hòa tan nhôm bằng 150ml dung dịch axit sunfuric 1,5M. Tính khối lượng nhôm đã dùng và nồng độ mol của muối tạo thành. Xem như thể tích thay đổi không đáng kể.
Câu 7. Cho 5,6g sắt tác dụng với 300ml dung dịch HCl 1,5M. Tính nồng độ chất sau phản ứng (Xem thể tích thay đổi không đáng kể)
Câu 8. Cho 16 gam hỗn hợp Mg, Fe tan hết trong 100 ml dd HCl 8M. Tính phần trăm khối lượng từng kim loại trong hỗn hợp
giải giúp em nha mọi người :))
thank mọi mười <3
Câu 1 :
+ Làm đổi màu chất chỉ thị màu : làm quỳ tím hóa đỏ
+ Tác dụng với kim loại :
vd : \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
+ Tác dụng với oxit bazo :
vd : \(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
\(BaO+H_2SO_4\rightarrow BaSO_4+H_2\)
+ Tác dụng với bazo :
vd : \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
\(KOH+HCl\rightarrow KCl+H_2O\)
Chúc bạn học tốt
Câu 2 :
+ Làm đổi màu chất chỉ thị màu : làm quỳ tím hóa xanh
+ Tác dụng với oxit axit :
vd : \(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
\(2KOH+CO_2\rightarrow K_2CO_3+H_2O\)
+ Tác dụng với axit :
vd : \(NaOH+HCl\rightarrow NaCl+H_2O\)
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\)
+ Bazo không tan bị nhiệt phân hủy :
vd : \(Zn\left(OH\right)_2\rightarrow\left(t_o\right)ZnO+H_2O\)
\(2Fe\left(OH\right)_3\rightarrow\left(t_o\right)Fe_2O_3+3H_2O\)
Chúc bạn học tốt
Câu 3 :
\(C_{NaCl}=\dfrac{25.100}{250}=10\)0/0
Câu 4 : \(n_{H2SO4}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
200ml = 0,2l
\(C_{M_{H2SO4}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
Câu 5 :
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,1 0,2 0,1
\(n_{H2}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,1.22,4=2,24\left(l\right)\)
\(n_{HCl}=\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
200ml = 0,2l
\(C_{M_{HCl}}=\dfrac{0,2}{0,2}=1\left(M\right)\)
Chúc bạn học tốt
nêu tính chất hóa học và mỗi tính chất viêt ví dụ một phương trình phản ứng của các chất:
a.oxi
b.hidro
c.nước
Oxi: Tính chất hóa học : oxi là một đơn chất phi kim hoạt động mạnh, đặc biệt là ở nhiệt độ cao, dễ dàng tham gia phản ứng hóa học với nhiều phi kim, nhiều kim loại và hợp chất. Trong các hợp chất hóa học, nguyên tố oxi có hóa trị II.
2SO2 + O2 → 2SO3
2Fe + O2 + 2H2O → 2Fe(OH)2
C5H12O2 + 7O2 → 5CO2 + 6H2O
Hidro: Tính chất hóa học
- Hidro là phi kim, Hydro có hóa trị 1 và có thể phản ứng với hầu hết các nguyên tố hóa học khác.
Bị kim loại (Fe, Ni, Pt, Pd) hấp thụ hóa học. Chất khử mạnh ở nhiệt độ cao. Hiđro nguyên tử Ho có khả năng khử đặc biệt cao, được tạo nên khi nhiệt phân hiđro phân tử H2 hay do phản ứng trực tiếp trong vùng tiến hành quá trình khử.
a. Tác dụng với kim loại
- Hidro tác dụng được với nhiều kim loại mạnh tạo hợp chất hidrua.
Ví dụ: H2 + 2Na → 2NaH (natri hidrua)
b. Tác dụng với phi kim: Hidro tác dụng được với nhiều phi kim
H2 + Cl2 → 2HCl
2H2 + O2 → 2H2O
3H2 + N2 → 2NH3.
c. Tác dụng với oxit kim loại
- Hidro khử được nhiều oxit kim loại ở nhiệt độ cao.
Ví dụ: FeO + H2 → Fe + H2O
CuO + H2 → Cu + H2O
Nước:
Tính chất hóa học của nước
- Tác dụng với kim loại: nước có thể tác dụng với một số kim loại ở nhiệt độ thường như Ca, Ba, K,…
PTHH: K + H2O → KOH + H2
- Tác dụng với mốt sô oxit bazo như CaO, K2O,… tạo ra bazo tương ứng Ca(OH)2, KOH,…
- Dung dịch bazơ làm quỳ tím chuyển xanh
VD: K2O + H2O → 2KOH
- Tác dụng với oxit axit như SO3, P2O5,… tạo thành axit tương ứng H2SO4, H3PO4,…
- Dung dịch axit làm quỳ tím chuyển đỏ
VD: SO3 + H2O → H2SO4
nêu tính chất hóa học và mỗi tính chất viêt ví dụ một phương trình phản ứng của các chất:
a.oxi
b.hidro
c.nước
tc hóa học của oxi là
+t/c vs phi kim; vd 5O2 +4P --\(t^0\) ---> 2P2O5
+ t/c vs kim loại; Vd 2Mg +O2--\(t^0\) --> 2MgO
+ tác dụng với hợp chất; vd: 2O2+ CH4--\(t^0\) ---> CO2 + 2H2O
tính chất hóa học của H
+ tác dụng vs oxi; vd 2H2 + O2--\(t^0\) ---> 2H2O
+ tác dụng vs 1 số oxit bazo; vd: H2 + HgO--\(t^0\) ---> H2O +Hg
t/c hóa học của nc
+ t/d vs kim loại: 2K + 2H2O ---> 2KOH +H2
+ t/d vs 1 số oxit bazo: Na2O + H2O---> 2NaOH
+ t/d vs 1 số oxit axit : SO2 + H2O---- > H2SO3
nêu tính chất hóa học và mỗi tính chất viêt ví dụ một phương trình phản ứng của các chất:
a.oxi
b.hidro
c.nước
nêu tính chất hóa học của oxi
-Oxi là một chất không màu, không mùi, ít tan trong nước.
- Oxi có khối lượng phân tử là 32 nên oxi nặng hơn không khí. - Oxi khi bị hóa lỏng ở nhiệt độ -1830C sẽ có màu xanh nhạt và có thể bị hút bởi nam châm.
Tính chất vật lí : Là chất khí, không màu, không mùi, ít tan trong nước, nặng hơn không khí.
Nêu tính chất hóa học của oxi, cho ví dụ kèm PTHH
GIÚP MÌNH VỚI Ạ
- Tác dụng với kim loại tạo oxit bazo tương ứng :
\(2Mg + O_2 \xrightarrow{t^o} 2MgO\\ 3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4\)
- Tác dụng với phi kim :
\(S + O_2 \xrightarrow{t^o} SO_2\\ 4P + 5O_2 \xrightarrow{t^o} 2P_2O_5\)
- Tác dụng với một số hợp chất khác :
\(CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ H_2S + \dfrac{3}{2}O_2 \xrightarrow{t^o} SO_2 + H_2O\)
1. Tác dụng với hầu hết với các kim loại ở nhiệt độ cao trừ Au,Pt,Ag
\(2Mg+O_2\underrightarrow{t^o}2MgO\)
2. Tác dụng với một số phi kim ở nhiệt độ cao
\(C+O_2\underrightarrow{t^o}CO_2\)
3. Tác dụng với một số hợp chất khác:
\(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
Phản ứng đặc trưng của oxi là phản ứng cháy. Oxi có thể tác dụng với hầu hết các kim loại dưới tác dụng của nhiệt độ để tạo ra các oxit (trừ kim loại vàng và bạch kim Oxi không phản ứng).
VD: PTHH: 2Cu + O2 _____> 2CuO
Câu 1. Nêu tính chất hóa học a/của oxi ví dụ về sự oxi hóa
Tham khảo:
Câu 1:
Khí oxi là một đơn chất phi kim rất hoạt động, đặc biệt ở nhiệt độ cao, dễ dàng tham gia phản ứng hóa học với nhiều phi kim, nhiều kim loại và hợp chất. Trong các hợp chất hóa học, nguyên tố oxi có hóa trị II.
Cụ thể:
- Tác dụng với kim loại: O2 oxi hóa được hầu hết các kim loại trừ Ag, Au, Pt.
Ví dụ:
- Tác dụng với hiđro, phản ứng có thể gây nổ mạnh nếu tỉ lệ thể tích O2 : H2 = 1:2
Phương trình hóa học:
- Tác dụng với một số phi kim khác:
Ví dụ:
+ Tác dụng với một số hợp chất:
Ví dụ: