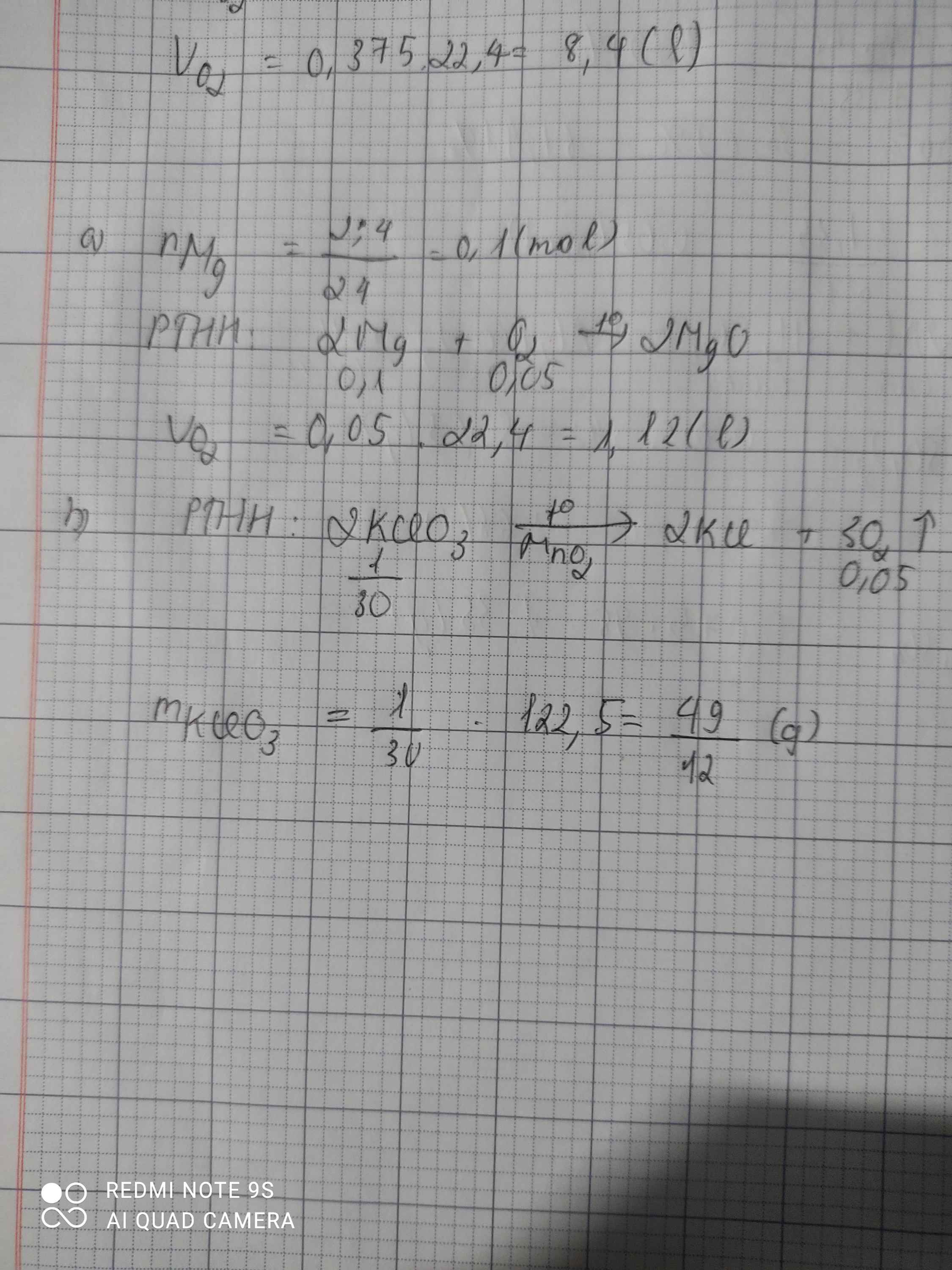Đốt cháy 2,4g Mg trong o2 thủ được Mgo tính mo2,co2,mMgO

Những câu hỏi liên quan
8) Đốt cháy hết 9 gam kim loại Magnesium (Mg) trong không khí thu được 15
gam hợp chất Magnesium oxide (MgO). Biết magnesium cháy là xảy ra phản
ứng với khí oxygen (O2) trong không khí.
a) Viết công thức về khối lượng của phản ứng xảy ra
A.mMg + mO2
= 2mMgO
B.mMg + mO2
= mMgO
C.2mMg+ mO2
= mMgO
D.mMg + 2mO2
= 2mMgO
\(PTHH:2Mg+O_2\rightarrow^{t^o}2MgO\\ \text{Bảo toàn KL: }m_{Mg}+m_{O_2}=m_{MgO}\\ \Rightarrow\text{Chọn B}\)
Đúng 1
Bình luận (0)
đốt cháy 1.8g mg trong o2 thu được mgo tính khối lượng mgo tạo thành?
\(n_{Mg}=\dfrac{1,8}{24}=0,075(mol)\\ 2Mg+O_2\xrightarrow{t^o}2MgO\\ \Rightarrow n_{MgO}=0,075(mol)\\ \Rightarrow m_{MgO}=0,075.40=3(g)\)
Đúng 2
Bình luận (0)
2Mg+O2-to>2MgO
0,075------------0,075 mol
n Mg=1,8\24=0,075 mol
=>m MgO=0,075.40=3g
Đúng 0
Bình luận (0)
\(2Mg + O_2 \rightarrow^{t^o} 2MgO\)
\(n_{Mg}=\dfrac{1,8}{24}=0,075 mol\)
Theo PTHH:
\(n_{MgO}=n_{Mg}= 0,075 mol\)
\(\Rightarrow m_{MgO}= 0,075 . 40=3 g\)
Đúng 0
Bình luận (0)
Để đốt cháy 7,2 (g) Mg cần dùng V (l) O2, thu đực m (g) MgO
a. Tính VO2
b. Tính mMgO
\(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\\ 2Mg+O_2\rightarrow\left(t^o\right)2MgO\\ n_{O_2}=\dfrac{0,3}{2}=0,15\left(mol\right)\\ n_{MgO}=n_{Mg}=0,3\left(mol\right)\\ a,V_{O_2\left(đktc\right)}=0,15.22,4=3,36\left(l\right)\\ b,m_{MgO}=0,3.40=12\left(g\right)\)
Đúng 3
Bình luận (0)
Đốt cháy 2,4g kim loại Mg trong Oxygen tạo ra 36g MgO
Sửa đề: 36 (g) → 3,6 (g)
Ta có: \(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
PT: \(2Mg+O_2\underrightarrow{t^o}2MgO\)
Theo PT: \(n_{MgO\left(LT\right)}=n_{Mg}=0,1\left(mol\right)\Rightarrow m_{MgO\left(LT\right)}=0,1.40=4\left(g\right)\)
\(\Rightarrow H=\dfrac{3,6}{4}.100\%=90\%\)
Đúng 2
Bình luận (2)
Câu 19.Tính số mol và thể tích của hỗn hợp khí (đktc) gồm có : 22g CO2, 8g O2 , 2,8gN2Câu 20. Đốt cháy hết 24g kim loại Mg trong không khí, sau phản ứng thu được MgO . a.Viết phương trình hóa học của phản ứng b.Tính khối lượng MgO tạo thành và thể tích (đktc) của khí O2 cần dùng
Đọc tiếp
Câu 19.Tính số mol và thể tích của hỗn hợp khí (đktc) gồm có : 22g CO2, 8g O2 , 2,8gN2
Câu 20. Đốt cháy hết 24g kim loại Mg trong không khí, sau phản ứng thu được MgO .
a.Viết phương trình hóa học của phản ứng
b.Tính khối lượng MgO tạo thành và thể tích (đktc) của khí O2 cần dùng
Câu 19
\(n_{CO_2}=\dfrac{22}{44}=0,5\left(mol\right)\)
=> VCO2 = 0,5.22,4 = 11,2 (l)
\(n_{O_2}=\dfrac{8}{32}=0,25\left(mol\right)\)
=> VO2 = 0,25.22,4 = 5,6 (l)
\(n_{N_2}=\dfrac{2,8}{28}=0,1\left(mol\right)\)
=> VN2 = 0,1.22,4 = 2,24 (l)
Câu 20
a) 2Mg + O2 --to--> 2MgO
b) \(n_{Mg}=\dfrac{24}{24}=1\left(mol\right)\)
2Mg + O2 --to--> 2MgO
_1--->0,5-------->1
=> mMgO = 1.40 = 40(g)
=> VO2 = 0,5.22,4 = 11,2 (l)
Đúng 0
Bình luận (0)
Đốt cháy hết 18 gam magnesium (Mg) trong khí oxygen (O2) thu được magnesium oxide (MgO).
a. Lập PTHH.
b. Tính khối lượng của MgO sinh ra sau phản ứng.
c. Tính thể tích Khí o2 cần cho phản ứng ở đkc.
Mg = 24, O=16
a) 2Mg + O2 --to--> 2MgO
b) \(n_{Mg}=\dfrac{18}{24}=0,75\left(mol\right)\)
=> nMgO = 0,75 (mol)
=> mMgO = 0,75.40 = 30(g)
c) nO2 = 0,375 (mol)
=> VO2 = 0,375.24,79 = 9,29625 (l)
Đúng 4
Bình luận (1)
đốt cháy 3.6 gam Magie trong khí oxi dư thu được MgO theo phương trình Mg + O2 -> MgO
\(n_{Mg}=0,15\left(mol\right)\)
\(2Mg+O_2\underrightarrow{t^o}2MgO\)
0,15-------------0,15 (mol)
\(m_{MgO}=0,15.40=6\left(g\right)\)
Đúng 1
Bình luận (0)
BÀI 2: Đốt cháy hoàn toàn 4,8 gam Mg trong khí oxygen (O2) thu được MgO.a. Viết phương trình hóa học.b. Tính thể tích khí O2 cần dùng ở đktc (25oC, 1 bar).c. Tính khối lượng MgO thu đượcBÀI 3: Đốt cháy hoàn toàn 2,4 gam Mg trong 1,6 gam khí oxygen (O2) thu được MgO.a. Viết công thức về khối lượng của phản ứng xảy ra.b. Tính khối lượng MgO thu được.c. Khối lượng khí O2 tham gia ở trên tương đương bao nhiêu phân tử?Cho: Mg 24; O 16; H 1
Đọc tiếp
BÀI 2: Đốt cháy hoàn toàn 4,8 gam Mg trong khí oxygen (O2) thu được MgO.
a. Viết phương trình hóa học.
b. Tính thể tích khí O2 cần dùng ở đktc (25oC, 1 bar).
c. Tính khối lượng MgO thu được
BÀI 3: Đốt cháy hoàn toàn 2,4 gam Mg trong 1,6 gam khí oxygen (O2) thu được MgO.
a. Viết công thức về khối lượng của phản ứng xảy ra.
b. Tính khối lượng MgO thu được.
c. Khối lượng khí O2 tham gia ở trên tương đương bao nhiêu phân tử?
Cho: Mg = 24; O = 16; H = 1
Bài 2:
a) 2Mg + O2 --to--> 2MgO
b) \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
PTHH: 2Mg + O2 --to--> 2MgO
_______0,2->0,1------>0,2
=> VO2 = \(\dfrac{0,1.0,082.\left(273+25\right)}{0,99}=2,468\left(l\right)\)
c) mMgO = 0,2.40 = 8(g)
Bài 3
a) Theo ĐLBTKL: mMg + mO2 = mMgO (1)
b) (1) => mMgO = 2,4 + 1,6 = 4(g)
c) \(nO_2=\dfrac{1,6}{32}=0,05\left(mol\right)\)
=> Số phân tử O2 = 0,05.6.1023 = 0,3.1023
Đúng 4
Bình luận (0)
Đốt cháy hoàn toàn 2,4g magie (Mg) trong khí oxi thu được magie oxit (MgO)
a) Tính thể tích khí oxi cần dùng (thể tích khí đo ở đktc)
b) Tính số gam KClO3 cần dùng để điều chế lượng oxi trên
\(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\\ a,2Mg+O_2\rightarrow\left(t^o\right)2MgO\\ n_{O_2}=\dfrac{0,1}{2}=0,05\left(mol\right)\\ V_{O_2\left(đktc\right)}=0,05.22,4=1,12\left(l\right)\\ b,2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\\ n_{KClO_3}=\dfrac{0,05.2}{3}=\dfrac{1}{30}\left(mol\right)\\ \Rightarrow m_{KClO_3}=\dfrac{122,5}{30}=\dfrac{49}{12}\left(g\right)\)
Đúng 1
Bình luận (0)