Nêu ứng dụng và điều chế khí oxi, hiđro

Những câu hỏi liên quan
Để điều chế khí oxi trong phòng thí nghiệm người ta tiến hành đun 12,25 gam KClO3 . Hãy a.Viết PT phản ứng b.Tính V khí oxi thu được ở điều kiện tiêu chuẩn c.Cho toàn bộ khí oxi thu được ở phản ứng trên tác dụng với 4,48 lít khí hiđro ở điều kiện tiêu chuẩn.Tính khối lượng nước thu được
nKClO3 - 12.25/122.5 = 0.1 (mol)
2KClO3 -to-> 2KCl + 3O2
0.1_______________0.15
VO2 = 0.15*22.4 = 3.36 (l)
nH2 = 4.48/22.4 = 0.2 (mol)
2H2 + O2 -to-> 2H2O
0.2___0.1______0.2
=> O2 dư
mH2O = 0.2*18 = 3.6(g)
Đúng 2
Bình luận (1)
n KClO3=m/M=12,25/122,5=0,1 (mol)
a/ 2KClO3 --> 2KCl +3O2
TPT: 2 2 3 (mol)
TĐB:0,1 0,1 0,15 (mol)
b/ V O2=n*22,4=0,15*22,4=3,36 ( l)
c/ n H2=V/22,4=4,48/22,4=0,2 (mol)
PTHH: 2H2 +O2 --> 2H2O
TPT: 2 1 2 (mol)
TĐB: 0,2 0,15 (mol)
Xét tỉ lệ 0,2/2 < 0,15/1
=> H2 pư hết O2 pư dư
n H2O= 0,2*2/2=0,2 (mol)
m H2O = n*M=0,2 *18=3,6 (g)
Mik chắc chắn đúng tại mik học sinh chuyên hóa
Đúng 1
Bình luận (1)
Nêu tính chất vật lí, tính chất hóa học, ứng dụng, điều chế khí oxi và khí hidro trong phòng thí nghiệm.
Hiện nay, để sản xuất amoniac, người ta điều chế nitơ và hiđro bằng cách chuyển hoá có xúc tác một hỗn hợp gồm không khí, hơi nước và khí metan (thành phần chính của khí thiên nhiên). Phản ứng giữa khí metan và hơi nước tạo ra hiđro và cacbon đioxit. Để loại khí oxi và thu khí nitơ, người ta đốt khí metan trong một thiết bị kín chứa không khí.Hãy viết phương trình hoá học của phản ứng điều chế khí hiđro, loại khí oxi và tổng hợp khí amoniac?
Đọc tiếp
Hiện nay, để sản xuất amoniac, người ta điều chế nitơ và hiđro bằng cách chuyển hoá có xúc tác một hỗn hợp gồm không khí, hơi nước và khí metan (thành phần chính của khí thiên nhiên). Phản ứng giữa khí metan và hơi nước tạo ra hiđro và cacbon đioxit. Để loại khí oxi và thu khí nitơ, người ta đốt khí metan trong một thiết bị kín chứa không khí.Hãy viết phương trình hoá học của phản ứng điều chế khí hiđro, loại khí oxi và tổng hợp khí amoniac?
Phương trình điều chế hiđro
CH4 + 2H2O -to, xt→ CO2 + 4H2
Phương trình loại khí oxi:
CH4 + 2O2 -to→ CO2 + 2H2O
Phương trình tống hợp amoniac:
N2 + 3H2 -450-500o, Fe, 200-300atm→ 2NH3
Đúng 0
Bình luận (0)
Cho dung dịch axit sunfuric loãng, nhôm và các dụng cu thí nghiệm như hình vẽ. Hãy chọn câu trả lời đúng trong các câu sau: A. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu khí oxi. B. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu không khí. C. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu khí hiđro. D. Có thể dùng để điều chế hidro nhưng không thu được khí hiđro.
Đọc tiếp
Cho dung dịch axit sunfuric loãng, nhôm và các dụng cu thí nghiệm như hình vẽ. Hãy chọn câu trả lời đúng trong các câu sau:
A. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu khí oxi.
B. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu không khí.
C. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu khí hiđro.
D. Có thể dùng để điều chế hidro nhưng không thu được khí hiđro.
Câu trả lời đúng là C.
PT: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Từ phản ứng này ⇒ có thể điều chế khí H2
Khí H2 nhẹ hơn không khí nên úp ngược ống nghiệm sẽ thu được khí H2
Đúng 0
Bình luận (0)
1. Tính chất vật lí , hoá học của oxi 2. Định nghĩa oxit , công thức của oxit , phân loại và cách gọi tên oxit 3. Điều chế khí oxi trong phòng thí nghiệm 4. Tính chất vật lí , hoá hợp của hiđro 5. Điều chế khí hiđro trong phòng thí nghiệm
Hiđro clorua ( hcl ) là một chất khí được dùng để sản xuất axit clohiđric ( 1 trong các axit được dùng phổ biến trong phòng thí nghiệm ) . trong công nghiệp , hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo. Tính thể tích khí clo ( ở đktc ) cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro (ở đktc ) và khối lượng khí Hiđro clorua thu được sau phản ứng . Nêu nêu các bước giải bài toán tính theo phương trình hóa học .
Đọc tiếp
Hiđro clorua ( hcl ) là một chất khí được dùng để sản xuất axit clohiđric ( 1 trong các axit được dùng phổ biến trong phòng thí nghiệm ) . trong công nghiệp , hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo. Tính thể tích khí clo ( ở đktc ) cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro (ở đktc ) và khối lượng khí Hiđro clorua thu được sau phản ứng .
Nêu nêu các bước giải bài toán tính theo phương trình hóa học .
1. Tính khối lượng chất tham gia và sản phẩm
* Các bước giải:
- Đổi số liệu đầu bài. Tính số mol của chất mà đầu bài cho.
- Lập phương trình hoá học.
- Dựa vào số mol chất đã biết để tính số mol chất cần tìm.
2. Tính thể tích khí tham gia và tạo thành
H2+Cl2->2HCl
\(n_{H_2}=67,2:22,4=3\left(mol\right)\)
Ta có: \(n_{H_2}=n_{Cl_2}=3\left(mol\right)\)
\(V_{Cl_2}=3.22,4=67,2l\)
\(n_{HCl}=2n_{Cl_2}=2.3=6\left(mol\right)\)
\(m_{HCl}=6.36,5=219g\)
Đúng 0
Bình luận (0)
Hiđro clorua (HCl) là một chất khí được dùng để sản xuất axit clohiđric (một trong các axit được dùng phổ biến trong phòng thí nghiệm). Trong công nghiệp, hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo. Tính thể tích khí clo (ở điều kiện tiêu chuẩn ) cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro ( ở đktc) và khối lượng khí hiđro clorua thu được sau phản ứng.Nêu các bước giải bài toán theo phương trình hoá học.
Đọc tiếp
Hiđro clorua (HCl) là một chất khí được dùng để sản xuất axit clohiđric (một trong các axit được dùng phổ biến trong phòng thí nghiệm). Trong công nghiệp, hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo. Tính thể tích khí clo (ở điều kiện tiêu chuẩn ) cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro ( ở đktc) và khối lượng khí hiđro clorua thu được sau phản ứng.
Nêu các bước giải bài toán theo phương trình hoá học.
b1: viết pthh
cl2+ h2-> 2hcl
b2: tính số mol cá chất dựa vào khối lượng hoăc thể tích đề bài cho
nH2= 67,2/224=3 mol
b3: dựa vào phương trình tính số mol các chất còn lại
theo pthh: ncl2=nh2=3 mol
nhcl=2nh2=3*2=6 mol
b4: tính khối lượng hoặc thể tích chất đề bài yêu cầu
=> Vcl2= 3*22,4=67,2l
mhcl=6* 36,5= 219g
CHÚC BẠN HỌC TỐT!
Đúng 1
Bình luận (9)
Bước 1: Tìm số mol chất đã cho trong đề bài.
nH2 = VH2/22,4 = 67,2/22,4 = 3 (mol)
Bước 2: Viết PTHH, cân bằng.
H2 + Cl2 -> 2HCl
Bước 3: Từ hệ số trong PTHH => số mol chất cần tìm.
3 mol -> 3 mol -> 6 mol
Bước 4: Tính theo yêu cầu đề bài.
- VCl2 = nCl2 . 22,4 = 3 . 22,4 = 67,2 (lít)
* Bài giải hoàn chỉnh:
- nH2 = VH2/22,4 = 67,2/22,4 = 3 (mol)
- H2 + Cl2 -> 2HCl
- 3 mol -> 3 mol -> 6 mol
- VCl2 = nCl2 . 22,4 = 3 . 22,4 = 67,2 (lít)
- mHCl = nHCl . MHCl = 6 . 36,5 = 219 (g)
Nếu bạn nào thắc mắc về câu trả lời của mk hay không hiểu chỗ nào, cứ việc bình luận. Mk sẽ nói rõ hơn! Mơn nhìu! >3<
Đúng 0
Bình luận (1)
Hiđro clorua (HCl) là một chất khí được dùng để sản xuất axit clohiđric (một trong các axit được dùng phổ biến trong phòng thí nghiệm). Trong công nghiệp, hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo. Tính thể tích khí clo (ở điều kiện tiêu chuẩn ) cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro ( ở đktc) và khối lượng khí hiđro clorua thu được sau phản ứng.Nêu các bước giải bài toán theo phương trình hoá học.
Đọc tiếp
Hiđro clorua (HCl) là một chất khí được dùng để sản xuất axit clohiđric (một trong các axit được dùng phổ biến trong phòng thí nghiệm). Trong công nghiệp, hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo. Tính thể tích khí clo (ở điều kiện tiêu chuẩn ) cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro ( ở đktc) và khối lượng khí hiđro clorua thu được sau phản ứng.
Nêu các bước giải bài toán theo phương trình hoá học.
Có: nH2= 67,2:22,4=3(mol)
PTPƯ: H2 + Cl2 --to--> 2 HCl
(mol) 1 1 2
(mol) 3 3 6
(l) 67,2 67,2 134,4
(g) 6 213 219
Đúng 0
Bình luận (0)
Bước 1: Viet PTHH
H2 + Cl2 \(\rightarrow\) 2HCl
Bước 2: Ta tính số mol các chất đã cho theo gia thiết
Số mol H2 la
\(n_{H_2}=\)\(V_{H_2}\): 22,4= 67,2 : 22,4 = 3 (mol)
Bước 3: Dựa vào PTHH, ta có thể tính số mol các chất còn lại
Theo PTHH: \(n_{H_2=}2n_{HCl}=3\cdot2=6\left(mol\right)\)
Bước 4: Tính khối lượng (m) hay thể tích (V) các chất cần tìm.
Thể tích Cl cần dùng là
\(V_{Cl}=n_{Cl}\cdot22,4=3\cdot22,4=67,2\left(l\right)\)
Khối lượng HCl thu được là
\(m_{HCl}=M_{HCl}\cdot n_{HCl}=36,5\cdot6=219\left(g\right)\)
Chúc bạn học giỏi.![]()
Đúng 0
Bình luận (0)
Trong những chất sau, những chất nào được dùng để điều chế khí oxi? Viết phương trình phản ứng và nêu điều kiện phản ứng:
C
u
S
O
4
;
K
C
l
O
3
;
C
a
C
O
3
;
K
M
n
O
4
;
H
2
O...
Đọc tiếp
Trong những chất sau, những chất nào được dùng để điều chế khí oxi? Viết phương trình phản ứng và nêu điều kiện phản ứng: C u S O 4 ; K C l O 3 ; C a C O 3 ; K M n O 4 ; H 2 O ; K 2 S O 4 ; HgO
Các chất được dùng để điều chế oxi: K C l O 3 ; K M n O 4 ; H 2 O ; HgO.
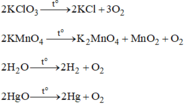
Đúng 0
Bình luận (0)



















