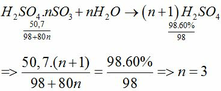....+....-->H2SO4

Những câu hỏi liên quan
h2so4 +AL---->
H2SO4 + BA(OH)2 ----->
H2SO4 +MG(OH)2 ----->
H2SO4 +AL2O3 ----->
H2SO4 + BACO3 ----->
\(2Al+3H_2SO_4\rightarrow3H_2+Al_2\left(SO_4\right)_3\)
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\)
\(Mg\left(OH\right)_2+H_2SO_4\rightarrow MgSO_4+2H_2O\)
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
\(BaCO_3+H_2SO_4\rightarrow BaSO_4+H_2O+CO_2\)
Đúng 5
Bình luận (0)
1. Al + H2SO4 →
2. Ca + H2SO4→
3. Cu + H2SO4 →
4. Mg + H2SO4 →
5. Fe + H2SO4 →
\(2Al+3H_2SO_4\left(l\right)\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Ca+H_2SO_4\left(l\right)\rightarrow CaSO_4+H_2\)
\(Cu+H_2SO_4\left(l\right)\rightarrow CuSO_4+H_2\)
\(Mg+H_2SO_4\left(l\right)\rightarrow MgSO_4+H_2\)
\(Fe+H_2SO_4\left(l\right)\rightarrow FeSO_4+H_2\)
Đúng 8
Bình luận (2)
1. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2.
2. Ca + H2SO4→ CaSO4 + H2.
3. Cu + H2SO4 (không phản ứng).
4. Mg + H2SO4 → MgSO4 + H2.
5. Fe + H2SO4 → FeSO4 + H2.
Đúng 2
Bình luận (0)
6) Cho các phản ứng sau- Hoàn thành các phương trình hóa học ?- Vai trò H2SO4 đặc là gì? (tính hoxi hóa, tính háo nước, tính axit mạnh)a) Cu + H2SO4 đặcb) Fe + H2SO4 đặc nguộic) H2SO4 đặc + Sd) H2SO4 đặc + KBre) H2SO4 đặc nguội + Alg) H2SO4 đặc + FeOh) H2SO4 đặc + Fe(OH)2i) H2SO4 đặc , dư + Fe (t0)m) C+ H2SO4 đặcn) H2SO4 đặc + NaOHo) H2SO4 đặc + MgOk) H2SO4 đặc + Fe2O3 ------
Đọc tiếp
6) Cho các phản ứng sau
- Hoàn thành các phương trình hóa học ?
- Vai trò H2SO4 đặc là gì? (tính hoxi hóa, tính háo nước, tính axit mạnh)
a) Cu + H2SO4 đặc
b) Fe + H2SO4 đặc nguội
c) H2SO4 đặc + S
d) H2SO4 đặc + KBr
e) H2SO4 đặc nguội + Al
g) H2SO4 đặc + FeO
h) H2SO4 đặc + Fe(OH)2
i) H2SO4 đặc , dư + Fe (t0)
m) C+ H2SO4 đặc
n) H2SO4 đặc + NaOH
o) H2SO4 đặc + MgO
k) H2SO4 đặc + Fe2O3
------
a) Cu + 2H2SO4 đặc->CuSO4+SO2+2H2O
b) Fe + H2SO4 đặc nguội-> ko pứ
c) 2H2SO4 đặc + S->3SO2+2H2O
d) H2SO4 đặc + KBr-> K2SO4 + Br2 + SO2 + 2H2O
e) H2SO4 đặc nguội + Al-> kopu
g) H2SO4 đặc + FeO->Fe2(SO4)3 + SO2 + H2O
h)4 H2SO4 đặc + 2Fe(OH)2->Fe2(SO4)3 + SO2 +6 H2O
i)6 H2SO4 đặc , dư + 2Fe (t0)->Fe2(SO4)3 +3 SO2 +6 H2O
m) C+ 2H2SO4 đặc-> CO2+2SO2+2H2O
n) H2SO4 đặc + 2NaOH->Na2SO4+2H2O
o) H2SO4 đặc + MgO->MgSO4+H2O
k)3 H2SO4 đặc + Fe2O3->Fe2(SO4)3+3H2O
Đúng 3
Bình luận (2)
a) tính oxi hóa
b)
c)oxi hóa
d)tính axit mạnh
e)
g), h) hóa nước
i) oxi hóa mạnh
m) oxi hóa
n háo nước
o) axit mạnh
k) axit mạnh
Đúng 0
Bình luận (2)
Cho các phản ứng sau: (1) Fe(OH)2 + H2SO4 đặc
→
(2) Fe + H2SO4 loãng
→
(3) Fe(OH)3 + H2SO4 đặc
→
(4) Fe3O4 + H2SO4 loãng
→
(5) Cu + H2SO4 loãng + dd NaNO3
→
(6) FeCO3 + H2SO4 đặc
→
Số phản ứng hóa học trong đó H2SO4 đóng vai trò là chất oxi hóa là: A. 3 B. 2 C. 4 D. 5
Đọc tiếp
Cho các phản ứng sau:
(1) Fe(OH)2 + H2SO4 đặc →
(2) Fe + H2SO4 loãng →
(3) Fe(OH)3 + H2SO4 đặc →
(4) Fe3O4 + H2SO4 loãng →
(5) Cu + H2SO4 loãng + dd NaNO3 →
(6) FeCO3 + H2SO4 đặc →
Số phản ứng hóa học trong đó H2SO4 đóng vai trò là chất oxi hóa là:
A. 3
B. 2
C. 4
D. 5
Đáp án A
Các phản ứng : (1) , (2) , (6)
Đúng 0
Bình luận (0)
Cho các phản ứng sau: (1) Fe(OH)2 + H2SO4 đặc
→
t
°
(2) Fe + H2SO4 loãng ¾¾® (3) Fe(OH)3 + H2SO4 đặc
→
t
°
(4) Fe3O4 + H2SO4 loãng ¾¾® (5) Cu + H2SO4 loãng + dung dịch NaNO3 ¾¾® (6) FeCO3 + H2SO4 đặc
→
t
°
Số phản ứng hóa học trong đó H2SO4 đóng vai trò là chất oxi hóa...
Đọc tiếp
Cho các phản ứng sau:
(1) Fe(OH)2 + H2SO4 đặc → t °
(2) Fe + H2SO4 loãng ¾¾®
(3) Fe(OH)3 + H2SO4 đặc → t °
(4) Fe3O4 + H2SO4 loãng ¾¾®
(5) Cu + H2SO4 loãng + dung dịch NaNO3 ¾¾®
(6) FeCO3 + H2SO4 đặc → t °
Số phản ứng hóa học trong đó H2SO4 đóng vai trò là chất oxi hóa là
A. 2
B. 4
C. 3
D. 5
H2SO4 + NaOH → Ba(OH)2 + H2SO4 →Mg(OH)2 + HCl → Fe(OH)3 + H2SO4 →HCl + BaCO3 → H2SO4 + CaCO3 →NaOH + MgCl2 → NaOH + BaCl2 →FeCl3 + KOH → FeCl2 + Mg(OH)2 →NaCl + AgNO3 → Ba(OH)2 + K2SO4 →Ba(OH)2 + Fe2(SO4)3 → ...
Đọc tiếp
H2SO4 + NaOH → Ba(OH)2 + H2SO4 →
Mg(OH)2 + HCl → Fe(OH)3 + H2SO4 →
HCl + BaCO3 → H2SO4 + CaCO3 →
NaOH + MgCl2 → NaOH + BaCl2 →
FeCl3 + KOH → FeCl2 + Mg(OH)2 →
NaCl + AgNO3 → Ba(OH)2 + K2SO4 →
Ba(OH)2 + Fe2(SO4)3 → Na2CO3 + BaCl2 →
BaSO4 + Na2CO3 → BaCO3 + Na2SO4 →
Ca(HCO3)2 + NaOH → NaHCO3 + NaOH →
2NaOH + H2SO4 → Na2SO4 + 2H2O
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
BaCO3 + 2HCl → H2O + CO2 + BaCl2
CaCO3 + H2SO4 → CO2 + CaSO4 + H2O
MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl
BaCl2 + 2NaOH → Ba(OH)2 + 2NaCl
FeCl3 + 3KOH → 3KCl + Fe(OH)3
Mg(OH)2 + FeCl2 → Fe(OH)2 + MgCl2
NaCl + (AgNO3) → AgCl + (NaNO3)
K2SO4 + Ba(OH)2 → BaSO4 + 2KOH
Fe2(SO4)3 + 3Ba(OH)2 → 3BaSO4 + 2Fe(OH)3
Na2CO3 + BaCl2 → BaCO3 + 2NaCl
2BaSO4 + Na2CO3 → 2NaSO4 + Ba2CO3
BaCO3 + Na2SO4 → BaSO4 + Na2CO3
Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 + 2H2O
NaHCO3 + NaOH → Na2CO3 + H2O
Đúng 3
Bình luận (0)
Thế nào là sự hóa than bởi H2SO4 đặc?5) Cho các phản ứng sau: Hãy hoàn thành phương trình phản ứng?a) S + O2b) FeS2 + O2 (t0)c) SO2 + O2 (t0, xt)d) nSO3 + H2SO4 đặce) H2SO4 đặc .nSO3 + H2Og) H2SO4 + BaCl2h) H2SO4 + Ba(OH)2i) H2SO4 + Ba(NO3)2k) Na2SO4 + BaCl2m) Na2SO4 + Ba(NO3)2o) Na2SO4 + Ba(OH)2
Đọc tiếp
Thế nào là sự hóa than bởi H2SO4 đặc?
5) Cho các phản ứng sau: Hãy hoàn thành phương trình phản ứng?
a) S + O2
b) FeS2 + O2 (t0)
c) SO2 + O2 (t0, xt)
d) nSO3 + H2SO4 đặc
e) H2SO4 đặc .nSO3 + H2O
g) H2SO4 + BaCl2
h) H2SO4 + Ba(OH)2
i) H2SO4 + Ba(NO3)2
k) Na2SO4 + BaCl2
m) Na2SO4 + Ba(NO3)2
o) Na2SO4 + Ba(OH)2
- Sự hóa than: biến hợp chất hữu cơ thành than
5)
a) \(S+O_2\underrightarrow{t^o}SO_2\)
b) \(4FeS_2+11O_2\underrightarrow{t^o}2Fe_2O_3+8SO_2\uparrow\)
c) \(2SO_2+O_2⇌2SO_3\) (điều kiện chiều thuận: to, V2O5)
d) \(nSO_3+H_2SO_4\rightarrow H_2SO_4.nSO_3\)
e) \(H_2SO_4.nSO_3+nH_2O\rightarrow\left(n+1\right)H_2SO_4\)
g) \(BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\)
h) \(H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4\downarrow+2H_2O\)
i) \(H_2SO_4+Ba\left(NO_3\right)_2\rightarrow BaSO_4\downarrow+2HNO_3\)
k) \(Na_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2NaCl\)
m) \(Na_2SO_4+Ba\left(NO_3\right)_2\rightarrow BaSO_4\downarrow+2NaNO_3\)
o) \(Na_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4\downarrow+2NaOH\)
Đúng 3
Bình luận (0)
Thế nào là sự hóa than bởi H2SO4 đặc?
Đó là sự oxi hóa của H2SO4 đối với các hợp chất hay chất hữu cơ để sau đó các chất sản phẩm hóa than
Đúng 1
Bình luận (0)
a) S + O2->SO2
b) FeS2 + \(\dfrac{7}{2}\)O2 (t0)->Fe2O3+2SO2
c) 2SO2 + O2 (t0, xt)-to>2SO3
d) nSO3 + H2SO4 đặc->nSO3.H2SO4
e) H2SO4 đặc .nSO3 + nH2O->(n+1)H2SO4
g) H2SO4 + BaCl2->BaSO4+2HCl
h) H2SO4 + Ba(OH)2->BaSO4+2H2O
i) H2SO4 + Ba(NO3)2->BaSO4+2HNO3
k) Na2SO4 + BaCl2->2NaCl+BaSO4
m) Na2SO4 + Ba(NO3)2->2NaNO3+BaSO4
o) Na2SO4 + Ba(OH)2->BaSO4+2NaOH
Xem thêm câu trả lời
Zn+H2SO4 đặc→......+S↓+.......
Mg+H2SO4 đặc→........+H2S↑+........
H2SO4(đặc, nóng)+S→SO2↑+........
3Zn + 4H2SO4đ -to> 3ZnSO4 + S + 4H2O
4Mg+5H2SO4 đ-to>4H2O+H2S+4MgSO4
S + 2H2SO4 → 3SO2 + 2H2O
Đúng 2
Bình luận (0)
Hòa tan 50,7 gam oleum có công thức H2SO4.nSO3 vào nước, thu được 98 gam dung dịch H2SO4 60%. Xác định giá trị n. H2SO4 nguyên chất có khả năng hấp thụ SO3 tạo oleum theo phương trình sau: H2SO4 + nSO3 → H2SO4.nSO3 (oleum)
Đọc tiếp
Hòa tan 50,7 gam oleum có công thức H2SO4.nSO3 vào nước, thu được 98 gam dung dịch H2SO4 60%. Xác định giá trị n.
H2SO4 nguyên chất có khả năng hấp thụ SO3 tạo oleum theo phương trình sau:
H2SO4 + nSO3 → H2SO4.nSO3 (oleum)
Cho các thí nghiệm sau: (1) Cho Mg vào dd H2SO4 (loãng). (2) Cho Fe3O4 vào dd H2SO4 (loãng). (3) Cho FeSO4 vào dd H2SO4 (đặc, nóng). (4) Cho Al(OH)3 vào dd H2SO4 (đặc, nóng). (5) Cho BaCl2 vào dd H2SO4 (đặc, nóng). (6) Cho Al(OH)3 vào dd H2SO4 (loãng) Trong các thí nghiệm trên, số thí nghiệm xảy ra phản ứng mà H2SO4 đóng vai trò là chất oxi hóa là A. 2 B. 4. C. 3. D. 5.
Đọc tiếp
Cho các thí nghiệm sau:
(1) Cho Mg vào dd H2SO4 (loãng).
(2) Cho Fe3O4 vào dd H2SO4 (loãng).
(3) Cho FeSO4 vào dd H2SO4 (đặc, nóng).
(4) Cho Al(OH)3 vào dd H2SO4 (đặc, nóng).
(5) Cho BaCl2 vào dd H2SO4 (đặc, nóng).
(6) Cho Al(OH)3 vào dd H2SO4 (loãng)
Trong các thí nghiệm trên, số thí nghiệm xảy ra phản ứng mà H2SO4 đóng vai trò là chất oxi hóa là
A. 2
B. 4.
C. 3.
D. 5.
Chọn A.
Thí nghiệm mà H2SO4 đóng vai trò chất oxi hoá (có số oxi hoá giảm) là (1), (3).
Đúng 0
Bình luận (0)