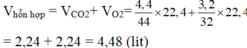Tính kg và thể tích hỗn hợp 0,2 gam O2; 0,5 mol khí H2 và 12*10^23 phân tử CO2

Những câu hỏi liên quan
GIÚP MÌNH VS F20: Tính thể tích ở đkc của : a. 0,2 mol O2b. 76,8 gam SO2c. 7,5 .1023 phân tử N2 d. Hỗn hợp X ( 0,2 mol O2 và 0,25 mol N2 )
Đọc tiếp
GIÚP MÌNH VS ![]()
F20: Tính thể tích ở đkc của :
a. 0,2 mol O2
b. 76,8 gam SO2
c. 7,5 .1023 phân tử N2
d. Hỗn hợp X ( 0,2 mol O2 và 0,25 mol N2 )
a)
$V_{O_2} = 0,2.22,4 = 4,48(lít)$
b)
$n_{SO_2} = \dfrac{76,8}{64} = 1,2(mol)$
$V_{SO_2} = 1,2.22,4 = 26,88(lít)$
c)
$n_{N_2} = \dfrac{7,5.10^{23}}{6.10^{23}} = 1,25(mol)$
$V_{N_2} = 1,25.22,4 = 28(lít)$
d)
$V_X = (0,2 + 0,25).22,4 = 10,08(lít)$
Đúng 2
Bình luận (0)
a) V(O2,đktc)=0,2.22,4=4,48(l)
b) V(SO2,đktc)= (76,8/64).22,4=26,88(l)
c) V(N2,đktc)= [(7,5.1023)/(6.1023)].22,4= 28(l)
d) VhhX(đktc)= V(O2,đktc) + V(N2,đktc)= 0,2.22,4+0,25.22,4=10,08(l)
Đúng 0
Bình luận (0)
F20: Tính thể tích ở đkc của :
a. 0,2 mol O2
=> \(V_{O_2}=0,2.22,4=4,48\left(l\right)\)
b. 76,8 gam SO2
\(n_{SO_2}=\dfrac{76,8}{32+16.2}=1,2\left(mol\right)\)
=> \(V_{SO_2}=1,2.22,4=26,88\left(l\right)\)
c. 7,5 .1023 phân tử N2
\(n_{N_2}=\dfrac{7,5.10^{23}}{6.10^{23}}=1,25\left(mol\right)\)
=> \(V_{N_2}=1,25.22,4=28\left(l\right)\)
Đúng 1
Bình luận (0)
thể tích của hỗn hợp gồm 0,2 mol H2 0,4 mol O2 0,6 mol NO và 0,8 mol CO2
A 44,8 gam
B 48,4 gam
C 40,8 gam
D 42,8 gam
Cách Làm
a)Khối lượng của 0,25 mol CuO.
b)Số phân tuer của 19 gam MgCl2.
c)Thể tích của hỗn hợp khí gồm: 0,2 mol CO2, 0,3 mol H2 và 6,4 gam O2(ở đktc).
a)mCuO=0.25*(64+16)=20(g)
b)\(n_{MgCl_2}=\dfrac{19}{95}=0.2\left(mol\right)\)
Số phân từ MgCl2 có trong 19g là
0.2*6*1023=1,2.1023
c)
\(V_{hh}=\left(0.2+0.3+\dfrac{6.4}{32}\right).22,4=\left(0.5+0.2\right)=0.7\cdot22,4=15,68\left(l\right)\)
Đúng 1
Bình luận (0)
Để cháy hoàn toàn hỗn hợp X gồm 3,84 gam Mg và 4,32 gam Al cần 5,824 lít hỗn hợp khí Y (đktc) gồm O2 và Cl2. Tính % thể tích Cl2 trong hỗn hợp Y? A. 46,15% B. 56,36% C. 43,64% D. 53,85%
Đọc tiếp
Để cháy hoàn toàn hỗn hợp X gồm 3,84 gam Mg và 4,32 gam Al cần 5,824 lít hỗn hợp khí Y (đktc) gồm O2 và Cl2. Tính % thể tích Cl2 trong hỗn hợp Y?
A. 46,15%
B. 56,36%
C. 43,64%
D. 53,85%
Tính thể tích ở đktc của một hỗn hợp khí gồm 4,4 gam C O 2 và 3,2 gam O 2
Hãy tính:
(a)Khối lượng của hỗn hợp gồm: 0,1 mol Mg và 0,2 mol Ca.
(b) Thể tích của hỗn hợp khí (ở đktc) gồm 2,8 gam N2 và 13,2 gam CO2
\(a.m_{Mg}=0,1.24=2,4\left(g\right)\\ m_{Ca}=0,2.40=8\left(g\right)\\ b.n_{hh}=\dfrac{2,8}{28}+\dfrac{13,2}{44}=0,4\left(mol\right)\\ \Rightarrow V_{hh}=0,4.22,4=8.96\left(l\right)\)
Đúng 1
Bình luận (0)
Cho 20 lit hỗn hợp khí methane và ethylen đi qua bình đựng dd brom 0,2 M thu được
37,6 gam dibromoethane
a. Viết PTHH?
b. Tính thể tích mỗi khí trong hỗn hợp?
c. Tính thành phần trăm theo thể tích mỗi khí trong hỗn hợp?
d. Tính thể tích dd brom cần dùng? Br = 80, C=12, H=1.
a) \(n_{C_2H_4Br_2}=\dfrac{37,6}{188}=0,2\left(mol\right)\)
PTHH: C2H4 + Br2 ---> C2H4Br2
0,2<---0,2<------0,2
b) \(\left\{{}\begin{matrix}V_{C_2H_4}=0,2.24,79=4,958\left(l\right)\\V_{CH_4}=20-4,958=15,042\left(l\right)\end{matrix}\right.\)
c) \(\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{4,958}{20}.100\%=24,79\%\\\%V_{CH_4}=100\%-24,79\%=75,21\%\end{matrix}\right.\)
d) \(V_{\text{dd}Br_2}=\dfrac{0,2}{0,2}=1\left(l\right)\)
Đúng 1
Bình luận (0)
a, \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
b, \(n_{C_2H_4Br_2}=\dfrac{37,6}{188}=0,2\left(mol\right)\)
\(n_{C_2H_4}=n_{C_2H_4Br_2}=0,2\left(mol\right)\Rightarrow V_{C_2H_4}=0,2.22,4=4,48\left(l\right)\)
\(\Rightarrow V_{CH_4}=20-4,48=15,52\left(l\right)\)
c, \(\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{4,48}{20}.100\%=22,4\%\\\%V_{CH_4}=77,6\%\end{matrix}\right.\)
d, \(n_{Br_2}=n_{C_2H_4Br_2}=0,2\left(mol\right)\Rightarrow V_{ddBr_2}=\dfrac{0,2}{0,2}=1\left(l\right)\)
Đúng 1
Bình luận (0)
Cho 20 lit hỗn hợp khí methane và ethylen đi qua bình đựng dd brom 0,2 M thu được37,6 gam dibromoethanea. Viết PTHH?b. Tính thể tích mỗi khí trong hỗn hợp?c. Tính thành phần trăm theo thể tích mỗi khí trong hỗn hợp?d. Tính thể tích dd brom cần dùng? Br 80, C12, H1.
Đọc tiếp
Cho 20 lit hỗn hợp khí methane và ethylen đi qua bình đựng dd brom 0,2 M thu được
37,6 gam dibromoethane
a. Viết PTHH?
b. Tính thể tích mỗi khí trong hỗn hợp?
c. Tính thành phần trăm theo thể tích mỗi khí trong hỗn hợp?
d. Tính thể tích dd brom cần dùng? Br = 80, C=12, H=1.
Hỗn hợp X gồm một ankan và một ankin. Cho hỗn hợp X qua dung dịch
Br
2
dư thấy thể tích hỗn hợp giảm đi một nửa. Tính thể tích
O
2
(đktc) cần dùng để đốt cháy hết 3,5 gam hỗn hợp X? A. 8,96 lít B. 5,6 lít C. 2,8 lít D. 8,4 lít
Đọc tiếp
Hỗn hợp X gồm một ankan và một ankin. Cho hỗn hợp X qua dung dịch Br 2 dư thấy thể tích hỗn hợp giảm đi một nửa. Tính thể tích O 2 (đktc) cần dùng để đốt cháy hết 3,5 gam hỗn hợp X?
A. 8,96 lít
B. 5,6 lít
C. 2,8 lít
D. 8,4 lít