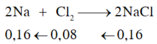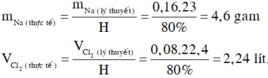Tính khối lượng KMnO4 cần dùng để điều chế 1120 lít khí Clo (điều kiện tiêu chuẩn).

Những câu hỏi liên quan
tính khối lượng KCLO3 cần dùng để điều chế 13,44 lít khí oxi ở điều kiện tiêu chuẩn
\(n_{O_2}=\dfrac{13,44}{22,4}=0,6mol\)
\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,4 0,6 ( mol )
\(m_{KClO_3}=0,4.122,5=49g\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 16,8 gam sắt trong không khí
a) Tính khối lượng sản phẩm thu được
b) Tính thể tích khí oxi, và thể tích không khí cần dùng ở điều kiện tiêu chuẩn ( biết oxi chiếm 20% thể tích không khí)
c) Tính khối lượng KMnO4 cần dùng để điều chế đủ oxi cho phản ứng trên? Biết rằng lượng oxi thu được hao hụt 20%
a) nFe = 16,8/56 = 0,3 (mol)
PTHH: 3Fe + 2O2 -> (t°) Fe3O4
Mol: 0,3 ---> 0,2 ---> 0,1
mFe3O4 = 0,1 . 232 = 23,2 (g)
b) VO2 = 0,2 . 22,4 = 4,48 (l)
Vkk = 4,48 . 5 = 22,4 (l)
c) H = 100% - 20% = 80%
nO2 (LT) = 0,2 : 80% = 0,25 (mol)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
nKMnO4 = 0,25 . 2 = 0,5 (mol)
mKMnO4 = 0,5 . 158 = 79 (g)
Đúng 4
Bình luận (0)
Khối lượng natri và thể tích khí clo ở điều kiện tiêu chuẩn cần để điều chế 9,36 gam muối NaCl là (biết H 80%) A. 3,68 gam và 2,24 lít B. 3,68 gam và 1,792 lít C. 4,6 gam và 1,792 lít. D. 4,6 gam và 2,24 lít
Đọc tiếp
Khối lượng natri và thể tích khí clo ở điều kiện tiêu chuẩn cần để điều chế 9,36 gam muối NaCl là (biết H = 80%)
A. 3,68 gam và 2,24 lít
B. 3,68 gam và 1,792 lít
C. 4,6 gam và 1,792 lít.
D. 4,6 gam và 2,24 lít
Hiđro clorua (HCl) là một chất khí được dùng để sản xuất axit clohiđric (một trong các axit được dùng phổ biến trong phòng thí nghiệm). Trong công nghiệp, hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo. Tính thể tích khí clo (ở điều kiện tiêu chuẩn ) cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro ( ở đktc) và khối lượng khí hiđro clorua thu được sau phản ứng.Nêu các bước giải bài toán theo phương trình hoá học.
Đọc tiếp
Hiđro clorua (HCl) là một chất khí được dùng để sản xuất axit clohiđric (một trong các axit được dùng phổ biến trong phòng thí nghiệm). Trong công nghiệp, hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo. Tính thể tích khí clo (ở điều kiện tiêu chuẩn ) cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro ( ở đktc) và khối lượng khí hiđro clorua thu được sau phản ứng.
Nêu các bước giải bài toán theo phương trình hoá học.
b1: viết pthh
cl2+ h2-> 2hcl
b2: tính số mol cá chất dựa vào khối lượng hoăc thể tích đề bài cho
nH2= 67,2/224=3 mol
b3: dựa vào phương trình tính số mol các chất còn lại
theo pthh: ncl2=nh2=3 mol
nhcl=2nh2=3*2=6 mol
b4: tính khối lượng hoặc thể tích chất đề bài yêu cầu
=> Vcl2= 3*22,4=67,2l
mhcl=6* 36,5= 219g
CHÚC BẠN HỌC TỐT!
Đúng 1
Bình luận (9)
Bước 1: Tìm số mol chất đã cho trong đề bài.
nH2 = VH2/22,4 = 67,2/22,4 = 3 (mol)
Bước 2: Viết PTHH, cân bằng.
H2 + Cl2 -> 2HCl
Bước 3: Từ hệ số trong PTHH => số mol chất cần tìm.
3 mol -> 3 mol -> 6 mol
Bước 4: Tính theo yêu cầu đề bài.
- VCl2 = nCl2 . 22,4 = 3 . 22,4 = 67,2 (lít)
* Bài giải hoàn chỉnh:
- nH2 = VH2/22,4 = 67,2/22,4 = 3 (mol)
- H2 + Cl2 -> 2HCl
- 3 mol -> 3 mol -> 6 mol
- VCl2 = nCl2 . 22,4 = 3 . 22,4 = 67,2 (lít)
- mHCl = nHCl . MHCl = 6 . 36,5 = 219 (g)
Nếu bạn nào thắc mắc về câu trả lời của mk hay không hiểu chỗ nào, cứ việc bình luận. Mk sẽ nói rõ hơn! Mơn nhìu! >3<
Đúng 0
Bình luận (1)
Hiđro clorua (HCl) là một chất khí được dùng để sản xuất axit clohiđric (một trong các axit được dùng phổ biến trong phòng thí nghiệm). Trong công nghiệp, hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo. Tính thể tích khí clo (ở điều kiện tiêu chuẩn ) cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro ( ở đktc) và khối lượng khí hiđro clorua thu được sau phản ứng.Nêu các bước giải bài toán theo phương trình hoá học.
Đọc tiếp
Hiđro clorua (HCl) là một chất khí được dùng để sản xuất axit clohiđric (một trong các axit được dùng phổ biến trong phòng thí nghiệm). Trong công nghiệp, hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo. Tính thể tích khí clo (ở điều kiện tiêu chuẩn ) cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro ( ở đktc) và khối lượng khí hiđro clorua thu được sau phản ứng.
Nêu các bước giải bài toán theo phương trình hoá học.
Có: nH2= 67,2:22,4=3(mol)
PTPƯ: H2 + Cl2 --to--> 2 HCl
(mol) 1 1 2
(mol) 3 3 6
(l) 67,2 67,2 134,4
(g) 6 213 219
Đúng 0
Bình luận (0)
Bước 1: Viet PTHH
H2 + Cl2 \(\rightarrow\) 2HCl
Bước 2: Ta tính số mol các chất đã cho theo gia thiết
Số mol H2 la
\(n_{H_2}=\)\(V_{H_2}\): 22,4= 67,2 : 22,4 = 3 (mol)
Bước 3: Dựa vào PTHH, ta có thể tính số mol các chất còn lại
Theo PTHH: \(n_{H_2=}2n_{HCl}=3\cdot2=6\left(mol\right)\)
Bước 4: Tính khối lượng (m) hay thể tích (V) các chất cần tìm.
Thể tích Cl cần dùng là
\(V_{Cl}=n_{Cl}\cdot22,4=3\cdot22,4=67,2\left(l\right)\)
Khối lượng HCl thu được là
\(m_{HCl}=M_{HCl}\cdot n_{HCl}=36,5\cdot6=219\left(g\right)\)
Chúc bạn học giỏi.![]()
Đúng 0
Bình luận (0)
Để điều chế khí oxi, người ta nung a gam KMnO4. Sau một thời gian nung ta thu được 100 gam chất rắn A và 6,72 lít khí O2 (đo ở điều kiện tiêu chuẩn). a. Viết phương trình phản ứng xảy ra khi nung KMnO4. b. Tính khối lượng KMnO4 ban đầu. c. Tính thành phần phần trăm theo khối lượng các chất trong A.
\(a,PTHH:2KMnO_4\rightarrow^{t^o}K_2MnO_4+MnO_2+O_2\\ b,n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ \Rightarrow m_{O_2}=0,3\cdot32=9,6\left(g\right)\\ \Rightarrow m_{KMnO_4\left(bđ\right)}=m_{\text{chất rắn}}+m_{O_2}=109,6\left(g\right)\\ c,n_{MnO_2}=0,3\left(mol\right)\\ \Rightarrow m_{MnO_2}=0,3\cdot87=26,1\left(g\right)\\ \Rightarrow\%_{MnO_2}=\dfrac{26,1}{100}\cdot100\%=26,1\%\\ \Rightarrow\%_{KMnO_4}=100\%-26,1\%=73,9\%\)
Đúng 1
Bình luận (0)
Nhiệt phân thuốc tím để điều chế khí O2 ai người ta thu được 6,12 lít khí O2 ở điều kiện tiêu chuẩn a) Tính khối lượng thuốc tím cần dùng b) Dùng toàn bộ khí co2 thu được ở trên Để đốt cháy hoàn toàn 5,4 gam Al thì sau phản ứng thu được bao nhiêu gam chất rắn
Xem chi tiết
2KMnO4 --to--> MnO2 + O2 + K2MnO4
0,6 <------------------------- 0,3 (mol)
a) nO2 = V/22,4 = 6,12/22,4 ≃ 0,3 (mol)
=> mKMnO4 = n . M = 0,6 . 158 = 94,8 ( g)
b) *PT (a) thu được khí O2
3O2 + 4Al --to--> 2Al2O3
0,3 -> 0,4 (mol)
mO2 = 0,3 . 32 = 9,6 (g)
mAl = 0,4 . 27 = 10,8 (g)
Khối lượng chất rắn cần tìm:
mAl2O3 = mO2 + mAl = 9,6 + 10,8 = 20,4 (g)
Đúng 3
Bình luận (0)
Nhiệt phân K M n O 4 thấy thoát ra 2,7552 lít khí ở điều kiện tiêu chuẩn. Tính khối lượng KMnO4 đã tham gia phản ứng.
A. 38,678 g
B. 38,868 g
C. 37,689 g
D. 38,886 g
Đáp án B
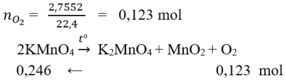
n K M n O 4 = 0 , 246 . 158 = 38 , 868 g
Đúng 0
Bình luận (0)
Tính khối lượng KMnO4 cần dùng để điều chế được 4,48 lít khí O2(ở đktc)
Xem chi tiết
\(n_{O_2} = \dfrac{4,48}{22,4} = 0,2(mol)\\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ n_{KMnO_4} = 2n_{O_2} = 0,4(mol)\\ \Rightarrow m_{KMnO_4} =0,4.158 = 63,2\ gam\)
Đúng 2
Bình luận (0)
PTHH: 2KMnO4 to->K2MnO4+MnO2+O2
Theo phương trình và theo đề bài:
->n KMnO4=0,1.2=0,2(mol)
Khối lượng thuốc tím cần dùng: m KMnO4=0,2.158=31,6(g)
Đúng 0
Bình luận (6)
Ta có: nO2=4,48/22,4=0,2(mol)
Phương trình hóa học: 2KMnO4 ---to---> K2MnO4 + MnO2 + O2.
Theo PT, ta có: nKMnO4=2.nO2=2.0,2=0,4(mol)
=> mKMnO4=0,4.158=63,2(g)
Đúng 0
Bình luận (0)