X và Y đều là hợp chất ion cấu tạo thành từ các ion có chung cấu hình electron 1 s 2 2 s 2 2 p 6 . Tổng số hạt proton, nơtron, electron trong phân tử X và Y lần lượt là
92 và 60. X và Y lần lượt là :
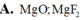
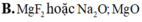
![]()
![]()
X và Y đều là hợp chất ion cấu tạo thành từ các ion có chung cấu hình electron 1s22s22p6. Tổng số hạt proton, nơtron, electron trong phân tử X và Y lần lượt là 92 và 60. X và Y lần lượt là :
A.MgO; MgF2
B. MgF2 hoặc Na2O; MgO
C. Na2O; MgO hoặc MgF2
D. MgO; Na2O.
Đáp án B
Anion có cấu hình1s22s22p6 => Anion là F hoặc O
Cation có cấu hình1s22s22p6 => Cation là Na hoặc Mg
Nếu anion là O, tổng số hạt p,n,e trong X là 92, X là Na2O (2pNa + nNa) + (2pO + nO) = 92
Tổng số hạt trong Y là 60, vậy Y là MgO.
Nếu anion là F.
Tổng số hạt trong X là 92. X là MgF2
X và Y đều là hợp chất ion cấu tạo thành từ các ion có chung cấu hình electron 1s22s22p6. Tổng số hạt proton, nơtron, electron trong phân tử X và Y lần lượt là 92 và 60. X và Y lần lượt là :
A. MgO; MgF2
B. MgF2 hoặc Na2O; MgO
C. Na2O; MgO hoặc MgF2
D. MgO; Na2O.
Đáp án B
![]()
![]()
![]()
![]()
- Giả sử anion là O
+ Tổng số hạt p, n, e trong phân tử X là 92. =>X là Na2O (2 × (11 × 2 + 12) + (8 × 2 + 8) = 92).
+ Tổng số hạt p, n, e trong phân tử Y là 60. =>Y là MgO ((12 × 2 + 12)+ (8 × 2 + 8) = 60).
- Giả sử anion là F
+ Tổng số hạt trong phân tử X là 92. => X là MgF2 ( (12 × 2 + 12) + 2 × (9 × 2 + 10) = 92)
Hợp chất M được cấu tạo từ anion Y2- và cation X+. Mỗi ion đều do 5 nguyên tử của 2 nguyên tố tạo thành. Tổng số proton trong X+ là 11, còn tổng số electron trong Y2- là 50. Công thức phân tử của hợp chất M là:
A. (NH4)2CrO4
B. (NH4)2S2O3
C. (NH4)2HPO3
D. (NH4)2SO4
Theo 4 đáp án X+ là NH4+
ion Y 2- có tổng số e là 50 và do 2 nguyên tố tạo thành.
♦ Đáp án A: tổng số e: 24+8.4+2=58 → loại
♦ Đáp án B: tổng số e: 16.2+8.3+2=58 → Loại
♦ Đáp án C: loại do có 3 chất tạo thành
♦ Đáp án D: tổng số e: 16+8.4+2=50 → thỏa mãn
Đáp án D
Một hợp chất ion Y được cấu tạo từ ion M+ và ion X-. Tổng số hạt electron trong Y bằng 36. Số hạt proton trong M+ nhiều hơn trong X- là 2. Vị trí của nguyên tố M và X trong bảng tuần hoàn hóa học các nguyên tố hóa học là
A. M: chu kì 3, nhóm IA; X: chu kì 3, nhóm VIIA.
B. M: chu kì 3, nhóm IB; X: chu kì 3, nhóm VIIA.
C. M: chu kì 4, nhóm IA; X: chu kì 4, nhóm VIIA.
D. M: chu kì 4, nhóm IA; X: chu kì 3, nhóm VIIA.
Đáp án D
Hợp chất Y được cấu tạo từ ion M+ và ion X- Hợp chất Y là MX
Theo giả thiết ta có:
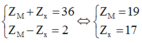
=> M là Kali và X là Cl
K có cấu hình electron là: 1s22s22p63s23p64s1
=> K thuộc chu kì 4; nhóm IA
Cl có cấu hình electron là: 1s22s22p63s23p5
=> Cl thuộc chu kì 3; nhóm VIIA
Một hợp chất ion Y được cấu tạo từ ion M+ và ion X-. Tổng số hạt electron trong Y bằng 36. Số hạt proton trong M+ nhiều hơn trong X- là 2. Vị trí của nguyên tố M và X trong bảng tuần hoàn hóa học các nguyên tố hóa học là
A. M: chu kì 3, nhóm IA; X: chu kì 3, nhóm VIIA
B. M: chu kì 3, nhóm IB; X: chu kì 3, nhóm VIIA.
C. M: chu kì 4, nhóm IA; X: chu kì 4, nhóm VIIA
D. M: chu kì 4, nhóm IA; X: chu kì 3, nhóm VIIA
Đáp án D
Hợp chất Y được cấu tạo từ ion M+ và ion X-
⇒ Hợp chất Y là MX
Theo giả thiết ta có:

⇒ M là Kali và X là Cl
K có cấu hình electron là: 1s22s22p63s23p64s1
⇒ K thuộc chu kì 4; nhóm IA
Cl có cấu hình electron là: 1s22s22p63s23p5
⇒ Cl thuộc chu kì 3; nhóm VIIA
Từ cấu hình e của ion viết cấu hình e của nguyên tử
a. Ion A+, B2+, D3+, X-, Y2-, Z3- đều có cấu hình electron là: 1s22s22p6. Viết cấu hình của A,
B, D, X, Y, Z.
b. Ion A+, B2+, X-, Y2-, Z3- đều có cấu hình electron là: 1s22s22p63s23p6. Viết cấu hình của
A, B, X, Y, Z
a) Viết phương trình biểu diễn sự hình thành các ion sau đây từ các nguyên tử tương ứng:
Na -> Na+ ; Cl -> Cl-
Mg -> Mg2+ ; S -> S2-
Al -> Al3+ ; O -> O2-
b) Viết cấu hình electron của các nguyên tử và các ion. Nhận xét về cấu hình electron lớp ngoài cùng của các ion được tạo thành.
a) Na -> Na+ + 1e ; Cl + 1e -> Cl-
Mg -> Mg2+ + 2e ; S + 2e -> S2-
Al -> Al3+ + 3e ; O + 2e -> O2-
b) Cấu hình electron của các nguyên tử và các ion:
11Na: 1s22s22p63s1 ; Na+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
17Cl: 1s22s22p63s23p5 ; Cl - : 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
12Mg: 1s22s22p63s2 ; Mg2+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
16S: 1s22s22p63s23p4 ; S2- : 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
13Al: 1s22s22p63s23p51 ; Al3+ : 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
8O: 1s22s22p4 ; O2- : 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
a) Viết phương trình biểu diễn sự hình thành các ion sau đây từ các nguyên tử tương ứng:
Na -> Na+ ; Cl -> Cl-
Mg -> Mg2+ ; S -> S2-
Al -> Al3+ ; O -> O2-
b) Viết cấu hình electron của các nguyên tử và các ion. Nhận xét về cấu hình electron lớp ngoài cùng của các ion được tạo thành.
a) Na -> Na+ + 1e ; Cl + 1e -> Cl-
Mg -> Mg2+ + 2e ; S + 2e -> S2-
Al -> Al3+ + 3e ; O + 2e -> O2-
b) Cấu hình electron của các nguyên tử và các ion:
11Na: 1s22s22p63s1 ; Na+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
17Cl: 1s22s22p63s23p5 ; Cl - : 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
12Mg: 1s22s22p63s2 ; Mg2+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
16S: 1s22s22p63s23p4 ; S2- : 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
13Al: 1s22s22p63s23p51 ; Al3+ : 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
8O: 1s22s22p4 ; O2- : 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.