A là dung dịch H 2 S O 4 có nồng độ 0,2M. B là dung dịch H 2 S O 4 có nồng độ 0,5M.
Nếu trộn A và B theo tỉ lệ thể tích V A : V B = 2:3 được dung dịch C. Hãy xác định nồng độ mol của dung dịch C.
A là dung dịch H 2 S O 4 có nồng độ 0,2M. B là dung dịch H 2 S O 4 có nồng độ 0,5M.
Phải trộn A và B theo tỉ lệ nào về thể tích để được dung dịch H 2 S O 4 có nồng độ 0,3M.
Pha chế dung dịch H 2 S O 4 0,3M.
Gọi x(l) là thể tích của dung dịch axit A.
y(l) là thể tích của dung dịch B.
n H 2 S O 4 ( A ) = C M . V A = 0,2 . x (mol)
n H 2 S O 4 ( B ) = C M . V B = 0,5 . y (mol)
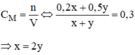
Vậy: ta phải trộn 2 thể tích dung dịch axit A với 1 thể tích dung dịch axit B, ta sẽ được dung dịch H 2 S O 4 có C M = 0,3M.
Hãy tính toán và pha chế các dung dịch sau:
1) 50g dung dịch đường có nồng độ 15%.
2) 100ml dung dịch natri clorua có nồng độ 0,2M.
3) 50g dung dịch đường 5% từ dung dịch đường có nồng độ 15% trở nên.
4) 50m dung dịch natri clorua có nồng độ 0,1M từ dung dịch natri clorua có nồng độ 0,2M ở trên.
1) Thực hành 1
Phần tính toán
Khối lượng chất tan (đường) cần dùng là:
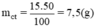
Khối lượng nước cần dùng là: 50 - 7,5 = 42,5(g).
Phần thực hành:
Cần 7,5g đường khan cho vào cốc có dung tích 100ml, khuấy đều với 42,5g nước, được 50g dung dịch đường 15%.
2) Thực hành 2
Phần tính toán
Số mol NaCl cần dùng là:
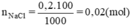
Có khối lượng là: 58,5 x 0,02 = 1,17(g).
Phần thực hành:
Cho 1,17g NaCl khan cho vào cốc chia độ. Rót từ từ nước vào cốc và khuấy đều đến cho vạch 100ml, được 100ml dung dịch NaCl 0,2M.
3) Thực hành 3
Phần tính toán
Khối lượng chất tan(đường) có trong 50g dung dịch đường 5% là:
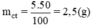
Khối lượng dung dịch đường 15% có chứa 2,5g đường là:
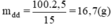
Khối lượng nước cần dùng là: 50 - 16,7 = 33,3(g).
Phần thực hành:
Cần 16,7g dung dịch đường 15% cho vào cốc có dung tích 100ml.Thêm 33,3g nước (hoặc 33,3ml) vào cốc, khuấy đều, được 50g dung dịch đường 5%.
4) Thực hành 4
Phần tính toán
Số mol chất tan (NaCl) có trong 50ml dung dịch 0,1M cần pha chế là:
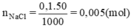
Thể tích dung dịch NaCl 0,2M trong đó có chứa 0,005mol NaCl là:
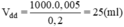
Phần thực hành:
Đong 25ml dung dịch NaCl 0,2M cho vào cốc chia độ. Rót từ từ nước vào cốc đến vạch 50ml. Khuấy đều, được 50ml dung dịch NaCl 0,1M.
Bài tập 4: Hòa tan 6 gam magie oxit (MgO) vào 50 ml dung dịch H2SO4 (có d = 1,2 g/ml) vừa đủ.
a. Tính khối lượng axit H2SO4 đã phản ứng ?
b. Tính nồng độ % của dung dịch H2SO4 axit trên ?
c. Tính nồng độ % của dung dịch muối sau phản ứng ?
Bài tập 5: Cho 200 gam dung dịch NaOH 4% tác dụng vừa đủ với dung dịch axit H2SO4 0,2M.
a. Tính thể tích dung dịch axit cần dùng ?
b. Biết khối lượng của dung dịch axit trên là 510 gam. Tính nồng độ % của chất có trong dung dịch sau phản ứng ?
Bài tập 6: Cho 11,2 gam Fe vào 200 ml dung dịch axit sunfuric nồng độ 3M. Tính nồng độ mol của các chất trong dung dịch sau phản ứng (coi thể tích dung dịch không đổi) ?
Bài tập 7: Hòa tan 1,6 gam đồng (II) oxit trong 100 gam dung dịch axit HCl 3,65%. Tính nồng độ % của các chất trong dung dịch thu được ?
Bài tập 4:
Số mol :
\(n_{MgO}=\dfrac{6}{40}=0,15mol\)
PHHH:
\(MgO\) + \(H_2SO_4\) ---> \(MgSO_4\) + \(H_2O\)
0,15 0,15 0,15 0,15
a,Theo phương trình :
\(n_{H_2SO_4}=0,15\Rightarrow m_{H_2SO_4}=0,15.98=14,7g\)b,
Ta có :
\(m_{ddH_2SO_4}=D.V=1,2.50=60\left(g\right)\)
\(\Rightarrow\) Nồng độ % của \(H_2SO_4\) là :
\(C\%_{ddH_2SO_4}=\dfrac{14,7}{60}.100\%=24,5\%\)
c, Theo phương trình :
\(n_{MgSO_4}=0,15\Rightarrow m_{MgSO_4}=0,15.120=18g\)Khối lượng dung dịch sau khi phản ứng là :
\(m_{ddsau}=m_{MgO}+m_{ddH_2SO}_{_4}=60+6=66g\)Nồng độ % dung dịch sau phản ứng là :
\(C\%_{ddsau}=\dfrac{18}{66}.100\%=27,27\%\)
Bài tập 4 :
Theo đề bài ta có :
nMgO=6/40=0,15(mol)
mddH2SO4=V.D=50.1,2=60(g)
ta có pthh :
MgO + H2SO4 \(\rightarrow\) MgSO4 + H2O
0,15mol...0,15mol...0,15mol
a) Khối lượng axit H2SO4 đã phản ứng là :
mH2SO4=0,15.98=14,7 g
b) Nồng độ % của dd axit là :
C%ddH2SO4=\(\dfrac{14,7}{60}.100\%=24,5\%\)
c) Nồng độ % của dung dịch sau p/ư là :
Ta có :
mct=mMgSO4=0,15.120=18 g
mddMgSO4=6 + 60 = 66 g
=> C%ddMgSO4=\(\dfrac{18}{66}.100\%\approx27,273\%\)
Vậy....
Bài 6:
Theo đề bài ta có :
\(nFe=0,2\left(mol\right)\)
nH2SO4=0,2.3=0,6 mol
PTHH : Fe + H2SO4 \(\rightarrow\) FeSO4 + H2\(\uparrow\)
------- 0,2mol..0,2mol.....0,2mol
Theo pthh :
nFe=\(\dfrac{0,2}{1}mol< nH2SO4=\dfrac{0,6}{1}mol\)
=> số mol của H2SO4 dư ( tính theo số mol của Fe)
Các chất thu được sau phản ứng bao gồm dd H2SO4 dư và dd FeSO4
Vì thể tích dung dịch ko đổi nên :
=> CMddFeSO4=\(\dfrac{0,2}{0,2}=1\left(M\right)\)
CMddH2SO4 dư = \(\dfrac{0,6-0,2}{0,2}=2\left(M\right)\)
Vậy.....
1/cho 16g oxit kim loại hóa trị 2 tác dụng vừa đủ với 200 g dung dịch H2SO4 thu được dung dịch A
a/xác định công thức oxit
b/tính nồng độ phần trăm các chất tan trong dung dịch A
2/cho 150ml dung dịch H2SO4 0,2M vào 180ml dung dịch NaOH 0,2 M
a/ Nhúng Quỳ tím vào dung dịch sau phản ứng có hiện tượng gì?
b/ Tính nồng độ mol của các chất tan trong dung dịch sau phản ứng
Bài 2:
Cho 9,4 g kali oxit tan hết trong 150,6 g nước được dung dịch A. Tính nồng độ % của A. Tính thể tích dung dịch HCl 0,5M cần dùng để tác dụng vừa đủ với dung dịch A.
Bài 3:
Hòa tan 23,5 g kali oxit vào 176,5 g nước được dung dịch A. Trung hòa vừa đủ A bằng dung dịch H2SO4 20% được dung dịch B. Tính:
a/ Nồng độ % dung dịch A. (14%)
b/ Khối lượng dung dịch H2SO4 cần dùng. (122,5g)
c/ Nồng độ % của muối trong dung dịch B. (13,49%)
Cho: H = 1 ; O = 16 ; Na = 23 ; S = 32 ; Cl = 35,5 ; K = 39
Câu 1:
\(n_{K2O}=\frac{9,4}{39.2+16}=0,1\left(mol\right)\)
\(K_2O+H_2O\rightarrow2KOH\)
0,1_____________0,2
\(C\%_{KOH}=\frac{0,2.\left(39+17\right)}{150,6+9,4}.100\%=7\%\)
\(KOH+HCl\rightarrow KCl+H_2O\)
0,2______0,2__________________
\(\Rightarrow V_{dd_{HCl}}=\frac{0,2}{0,5}=0,5\left(l\right)\)
Câu 2:
a, \(n_{K2O}=\frac{23,5}{39.2+16}=0,25\left(mol\right)\)
\(2n_{K2O}=n_{KOH}\Rightarrow n_{KOH}=0,25.2=0,5\left(mol\right)\)
\(C\%_{KOH}=\frac{0,5.\left(39+17\right)}{176,5+23,5}.100\%=14\%\)
b, \(n_{KOH}=2n_{K2SO4}\Rightarrow n_{K2SO4}=\frac{0,5}{2}=0,25\)
\(n_{H2SO4}=n_{K2SO4}=0,25\)
\(m_{dd_{H2SO4}}=\frac{0,25.98}{20\%}=122,5\left(g\right)\)
c,
mdd sau phản ứng=mddA+mddH2SO4
m dd sau phản ứng \(=23,5+176,5+122,5=322,5\)
\(C\%_{K2SO4}=\frac{0,25.\left(39.2+32+16.4\right)}{322,5}.100\%=13,49\%\)
A là dung dịch H2SO4 0,2M; Blaf dung dịch H2SO4 0,5M.
Trộn A và B theo tỉ lệ thể tích: VA:VB=2:1 được dung dịch C. Xác định nồng độ mol của dung dịch C. lấy V1 lit dung dịch HCl 0,6M trộn với V2 lit dung dịch NaOH 0,4M. Thu được dung dịch A(tổng V1+V2 =0.6l). biết 0,6l dung dịch A hoàn tan vừa đủ 0,02 mol Al2O3. Tính V1;V2.
Hòa tan 12,4 gam Na2O vào 1 lít dung dịch NaOH 0,2M ( thể tích của dung dịch sau khi hòa tan không thay đổi). Tính nồng độ mol của dung dịch thu được.
\(\text{1) Na2O+H2O->2NaOH}\)
Ta có :
\(\text{nNaOH=2x12,4/62+1x0,2=0,6(mol)}\)
\(\Rightarrow\text{CMNaOH=0,6/1=0,6(M)2}\)
Cho 20g NaOH tác dụng với dung dịch H2SO4 có nồng độ là 20%
a/ Tính khối lượng dung dịch H2SO4
b/ Tính nồng độ % dung dịch muối (Na2SO4)
(Na=23, S=32, O=16, H=1)
\(n_{NaOH}=\frac{m}{M}=\frac{20}{40}=0,5mol\)
PTHH:
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0,5 0,25 0,25 0,5 (mol)
b)\(m_{H_2SO_4}=n.M=0,25.98=24,5g\)
\(m_{ddH_2SO_4}=\frac{24,5.100}{20}=122,5g\)
c)\(m_{Na_2SO_4}=n.M=0,25.142=35,5g\)\(m_{ddNa_2SO_4}=m_{NaOH}+m_{ddH_2SO_4}=20+122,5=142,5g\)\(C\%_{Na_2SO_4}=\frac{35,5.100}{142,5}=24,91\%\)
PTHH: 2NaOH+H2SO4--->Na2SO4+2H2O
nNaOH = 20/40 = 0,5 (mol)
=>mH2SO4 = 0,25.98 = 24, 5 g
=> mddH2SO4 = 122,5g
=>mNa2SO4 = 0,25. 142 = 35,5g
=> mdd Na2SO4 = 142,5g
=>C%Na2SO4 = 24,91%
2NaOH + H2SO4---->Na2SO4+ 2H2O
a) Ta có
n\(_{NaOH}=\frac{20}{40}=0,5\left(mol\right)\)
Theo pthh
n\(_{H2SO4}=\frac{1}{2}n_{NaOH}=0,25\left(mol\right)\)
m\(_{H2SO4}=\frac{0,25.98.100}{20}=122,5\left(g\right)\)
b)Theo pthh
n\(_{Na2SO4}=\frac{1}{2}n_{NaOH}=0,25\left(mol\right)\)
m\(_{Na2SO4}=0,25.142=35,5\left(g\right)\)
C%=\(\frac{35,5}{122,5+40}.100\%=21,85\%\)
Chúc bạn học tốt
Cho dd A chứa CuSO4 nồng độ x%. Sau khi bay hơi 20% khối lượng nước thì dung dịch bão hòa. Thêm 2,75g CuSO4 vào dung dịch bão hòa thì có 5g CuSO4.5H2O kết tinh
a) Tính nồng độ phần trăm dung dịch bão hòa
b) Tính nồng độ phần trăm dung dịch A
Số mol của CuSO4.5H2O=5/160= 0,02 mol.
=> Trong 5 gam tinh thể có 0,02*160=3,2 gam CuSO4 và 1,8 gam H2O.
Lượng CuSO4 tách ra = 3,2 - 2,75 = 0,45 gam.
Lượng H2O tách ra = 1,8 gam.
C% của dung dịch bão hòa= 0,45*100%/(0,45+1,8)= 20%.
Lượng H2O trong dung dịch A ban đầu = 1,8*100/80= 2,25 gam.
Nồng độ dung dịch A= 0,45*100/(0,45+2,25)= 16,67%.