Cho 0,81 gam Al tác dụng với 500 ml dung dịch X chứa F e N O 3 2 0,1M và C u N O 3 2 0,09M. Sau khi phản ứng kết thúc thu được m gam chất rắn. Giá trị của m là
A. 2,88
B. 2,08
C. 1,68
D. 1,08
Cho m gam hỗn hợp Y gồm 2,8 gam Fe và 0,81 gam Al vào 200 ml dung dịch X chứa AgNO3 và Cu(NO3)2. Khi phản ứng kết thúc được dung dịch Y và 8,12 gam chất rắn E gồm 3 kim loại. Cho chất rắn E tác dụng với dung dịch HCl dư thì được 0,672 lít H2 (đktc). Nồng độ mol của AgNO3 trong dung dịch X là
A. 0,5M
B. 0,1M
C. 0,15M
D. 0,05M
Cho hỗn hợp X gồm 2,80 gam Fe và 0,81 gam Al vào 500 ml dung dịch Y chứa AgNO3 và Cu(NO3)2 đến khi phản ứng kết thúc, thu được dung dịch Z và 8,12 gam chất rắn T gồm 3 kim loại. Cho T tác dụng với dung dịch HCl dư, thu được 0,672 lít khí H2 (đktc). Nồng độ mol của Cu(NO3)2 và AgNO3 trong dung dịch Y tương ứng là
A. 0,2 và 0,3.
B. 0,2 và 0,02.
C. 0,1 và 0,03.
D. 0,1 và 0,06.
Cho hỗn hợp X gồm 2,80 gam Fe và 0,81 gam Al vào 500 ml dung dịch Y chứa AgNO3 và Cu(NO3)2 đến khi phản ứng kết thúc, thu được dung dịch Z và 8,12 gam chất rắn T gồm 3 kim loại. Cho T tác dụng với dung dịch HCl dư, thu được 0,672 lít khí H2 (đktc). Nồng độ mol của Cu(NO3)2 và AgNO3 trong dung dịch Y tương ứng là
A. 0,2 và 0,3
B. 0,2 và 0,02
C. 0,1 và 0,03
D. 0,1 và 0,06
Dung dịch X chứa các ion sau: Al3+, Cu2+, S O 4 2 - và N O 3 - . Để kết tủa hết ion có trong 500 ml dung dịch X cần 100 ml dung dịch BaCl2 1M. Cho 500 ml dung dịch X tác dụng với dung dịch NaOH dư thì được 19,6 gam kết tủa. Cô cạn 500 ml dung dịch X được 66,75 gam hỗn hợp muối khan. Nồng độ mol/l của N O 3 - là:
Một hợp kim có chứa 2,8 gam Fe và 0,81 gam Al. Cho hợp kim vào 200 ml dung dịch X chứa AgNO 3 và Cu NO 3 2 sau khi phản ứng kết thúc được dung dịch Y và 8,12 gam chất rắn Z gồm 3 kim loại. Cho chất rắn Z tác dụng với dung dịch HC1 dư được 0,672 lít H 2 (ở đktc). Nồng độ mol của dung dịch AgNO 3 là
A. 0,1
B. 0,15
C. 0,28
D. 0,25
Cho 0,81 gam Al và 2,8 gam Fe tác dụng với 200 ml dung dịch X chứa AgNO3 và Cu(NO3)2. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y và 8,12 gam hỗn hợp 3 kim loại. Cho 8,12 gam hỗn hợp 3 kim loại này tác dụng với dung dịch HCl dư. Kết thúc phản ứng thấy thoát ra 0,672 lít khí H2 (đktc). Nồng độ mol của AgNO3 và Cu(NO3)2 lần lượt là:
A. 0,15M và 0,25M
B. 0,10M và 0,20M
C. 0,25M và 0,15M
D. 0,25M và 0,25M
Đáp án A
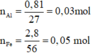
Sau phản ứng thu được 3 kim loại => Fe còn dư; Al, AgNO3 và Cu(NO3)2 đều phản ứng hết; 3 kim loại thu được gồm Ag, Cu và Fe dư.
![]()
Đặt số mol của AgNO3 và Cu(NO3)2 lần lượt là a, b
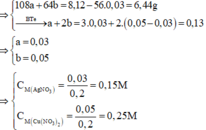
. Cho 2,8 gam bột Fe và 0,81 gam Al vào 100 ml dung dịch A chứa Cu(NO3)2 và AgNO3, khuấy kỹ đến khi phản ứng kết thúc. Sau phản ứng còn lại chất rắn B gồm 3 kim loại có khối lượng 8,12 gam. Cho chất rắn B tác dụng với dung dịch HCl dư thu được 0,672 lít H2 (ở đktc). Tính nồng độ mol của từng muối trong dung dịch A.
\(n_{Fe}=\dfrac{2,8}{56}=0,05mol\)
\(n_{Al}=\dfrac{0,81}{27}=0,03mol\)
\(B:8,12g\left\{{}\begin{matrix}Cu:a\left(mol\right)\\Ag:b\left(mol\right)\\Fe:c\left(mol\right)\end{matrix}\right.\Rightarrow64a+108b+56c=8,12\)(*)
\(n_{H_2}=\dfrac{0,672}{22,4}=0,03mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,03 0,03
\(\Rightarrow c=n_{Fe}=0,03mol\)
Thay vào (*) ta được: \(64a+108b=8,12-0,03\cdot56\left(1\right)\)
\(n_{Fepư}=0,05-0,03=0,02mol\)
\(BTe:2n_{Cu}+n_{Ag}=3n_{Fepư}+2n_{H_2}\)
\(\Rightarrow2a+b=2\cdot0,02+3\cdot0,03\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,05\\b=0,03\end{matrix}\right.\)
\(C_{M_{Cu\left(NO_3\right)_2}}=\dfrac{0,05}{0,1}=0,5M\)
\(C_{M_{AgNO_3}}=\dfrac{0,03}{0,1}=0,3M\)
Lắc 0,81 gam bột nhôm trong 200 ml dung dịch X chứa AgNO3 và Cu(NO3)2 một thời gian, thu được chất rắn A và dung dịch B. Cho A tác dụng với dung dịch NaOH dư thu được 100,8 ml khí H2 (đktc) và cịn lại 6,012 gam hỗn hợp hai kim loại. Cho B tác dụng với dung dịch NaOH dư được kết tủa, đem nung kết tủa đến khối lượng khơng đổi thu được 1,6 gam oxit.
1. Viết các phương trình hóa học xảy ra.
2. Tính nồng độ mol/lít của AgNO3 và Cu(NO3)2 trong dung dịch X.
1)
- Trong A chứa Al, Cu, Ag
- Do trong A chứa Cu => Ag bị đẩy ra hết khỏi dd
- Do cho B tác dụng với NaOH dư thu được kết tủa
=> Trong B chứa Al(NO3)3, Cu(NO3)2
Al + 3AgNO3 --> Al(NO3)3 + 3Ag
2Al + 3Cu(NO3)2 --> 2Al(NO3)3 + 3Cu
2Al + 2NaOH + 2H2O --> 2NaAlO2 + 3H2
Al(NO3)3 + 3NaOH --> Al(OH)3 + 3NaNO3
Al(OH)3 + NaOH --> NaAlO2 + 2H2O
Cu(NO3)2 + 2NaOH --> Cu(OH)2 + 2NaNO3
Cu(OH)2 --to--> CuO + H2O
2)
Rắn sau khi nung là CuO
\(n_{CuO}=\dfrac{1,6}{80}=0,02\left(mol\right)\)
=> \(n_{Cu\left(NO_3\right)_2\left(B\right)}=0,02\left(mol\right)\)
\(n_{H_2}=\dfrac{0,1008}{22,4}=0,0045\left(mol\right)\)
PTHH: 2Al + 2NaOH + 2H2O --> 2NaAlO2 + 3H2
0,003<---------------------------------0,0045
Bảo toàn Al: \(n_{Al\left(NO_3\right)_3\left(B\right)}=\dfrac{0,81}{27}-0,003=0,027\left(mol\right)\)
Gọi số mol Cu, Ag trong hỗn hợp kim loại là a, b (mol)
=> 64a + 108b = 6,012 (1)
Bảo toàn Ag: \(n_{AgNO_3\left(X\right)}=b\left(mol\right)\)
Bảo toàn Cu: \(n_{Cu\left(NO_3\right)_2\left(X\right)}=a+0,02\left(mol\right)\)
Bảo toàn \(NO_3^-\): \(n_{AgNO_3\left(X\right)}+2.n_{Cu\left(NO_3\right)_2\left(X\right)}=3.n_{Al\left(NO_3\right)_3\left(B\right)}+2.n_{Cu\left(NO_3\right)_2\left(B\right)}\)
=> \(b+2a+0,04=3.0,027+2.0,02\)
=> 2a + b = 0,081 (2)
(1)(2) => a = 0,018 (mol); b = 0,045 (mol)
=> \(\left\{{}\begin{matrix}n_{AgNO_3\left(X\right)}=0,045\left(mol\right)\\n_{Cu\left(NO_3\right)_2\left(X\right)}=0,038\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}C_{M\left(AgNO_3\right)}=\dfrac{0,045}{0,2}=0,225M\\C_{M\left(Cu\left(NO_3\right)_2\right)}=\dfrac{0,038}{0,2}=0,19M\end{matrix}\right.\)
Có 500 ml dung dịch X chứa Na+, NH4+, C O 3 2 - và S O 4 2 - . Lấy 100 ml dung dịch X tác dụng với lượng dư dung dịch HCl thu 2,24 lít khí (đktc). Lấy 100 ml dung dịch X cho tác dụng với lượng dư dung dịch BaCl2 thấy có 43 gam kết tủa. Lấy 100 ml dung dịch X tác dụng với lượng dư dung dịch NaOH thu 4,48 lít khí NH3 (đktc). Tính tổng khối lượng muối có trong 500 ml dung dịch X.
A. 14,9 gam.
B. 11,9 gam.
C. 86,2 gam.
D. 119 gam.