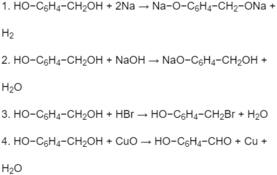
Viết phương trình hóa học của CuO lần lượt với dung dịch HCl, dung dịch H 2 S O 4 loãng

Những câu hỏi liên quan
Sục Cl2 vào dung dịch KOH loãng thu được dung dịch A, hòa tan I2 vào dung dịch KOH loãng thu được dung dịch B (tiến hành ở nhiệt độ phòng).1) Viết phương trình hóa học xảy ra.2) Viết phương trình hóa học xảy ra khi cho lần lượt các dung dịch: hỗn hợp HCl và FeCl2, Br2, H2O2, CO2 vào dung dịch A (không có Cl2 dư, chỉ chứa các muối).
Đọc tiếp
Sục Cl2 vào dung dịch KOH loãng thu được dung dịch A, hòa tan I2 vào dung dịch KOH loãng thu được dung dịch B (tiến hành ở nhiệt độ phòng).
1) Viết phương trình hóa học xảy ra.
2) Viết phương trình hóa học xảy ra khi cho lần lượt các dung dịch: hỗn hợp HCl và FeCl2, Br2, H2O2, CO2 vào dung dịch A (không có Cl2 dư, chỉ chứa các muối).
a) Ở nhiệt độ thường:
2KOH + Cl2 \(\rightarrow\) KCl + KClO + H2O
6KOH + 3I2 \(\rightarrow\) 5KI + KIO3 + 3H2O
(Trong môi trường kiềm tồn tại cân bằng : \(\text{3XO- ⇌X- + XO}_3^-\)
Ion ClO- phân hủy rất chậm ở nhiệt độ thường và phân hủy nhanh khi đun nóng, ion IO- phân hủy ở tất cả các nhiệt độ).
b) Các phương trình hóa học :
Ion ClO- có tính oxi hóa rất mạnh, thể hiện trong các phương trình hóa học:
- Khi cho dung dịch FeCl2 và HCl vào dung dịch A có khí vàng lục thoát ra và dung dịch từ không màu chuyển sang màu vàng nâu :
2FeCl2 + 2KClO + 4HCl \(\rightarrow\) 2FeCl3 + Cl2 + 2KCl + 2H2O
- Khi cho dung dịch Br2 vào dung dịch A, dung dịch brom mất màu :
Br2 + 5KClO + H2O \(\rightarrow\) 2HBrO3 + 5KCl
- Khi cho H2O2 vào dung dịch A, có khí không màu, không mùi thoát ra:
H2O2 + KClO \(\rightarrow\) H2O + O2 + KCl
- khi cho CO2 vào A
CO2 + KClO + H2O \(\rightarrow\) KHCO3 + HClO
Đúng 0
Bình luận (0)
Gíup em với ạ1.Viết phương trình hóa học khi cho dung dịch HCl lần lượt tác dụng với:a) Znb) Copper (II) Oxide (CuO)c) Barrium Hydroxide Ba(OH) 2d) Iron (III) Hydroxide Fe(OH) 32.Hòa tan 2,4g Mg bằng 100ml dung dịch HCl 3M:a) Viết phương trình hóa học của phản ứng xảy rab) Tính thể tích khí thoát ra ở điều kiện chuẩnc) Tính C M của dung dịch thu được sau phản ứng (Coi thể tích dung dịch sau phản ứng bằngvới thể tích dung dịch HCl)
Đọc tiếp
Gíup em với ạ
1.Viết phương trình hóa học khi cho dung dịch HCl lần lượt tác dụng với:
a) Zn
b) Copper (II) Oxide (CuO)
c) Barrium Hydroxide Ba(OH) 2
d) Iron (III) Hydroxide Fe(OH) 3
2.Hòa tan 2,4g Mg bằng 100ml dung dịch HCl 3M:
a) Viết phương trình hóa học của phản ứng xảy ra
b) Tính thể tích khí thoát ra ở điều kiện chuẩn
c) Tính C M của dung dịch thu được sau phản ứng (Coi thể tích dung dịch sau phản ứng bằng
với thể tích dung dịch HCl)
Bài 1:
a. Zn + 2HCl -> ZnCl2 + H2
b. CuO + 2HCl -> CuCl2 + H2O
c. Ba(OH)2 + 2HCl - > BaCl2 + 2H2O
d. Fe(OH)3 + 3HCl -> FeCl3 + 3H2O
Đúng 0
Bình luận (0)
B1:
\(a,Zn+2HCl\rightarrow ZnCl_2+H_2\\ b,CuO+2HCl\rightarrow CuCl_2+H_2O\\ c,Ba\left(OH\right)_2+2HCl\rightarrow BaCl_2+2H_2O\\d, Fe\left(OH\right)_3+3HCl\rightarrow FeCl_3+3H_2O\)
B2:
\(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\\ n_{HCl}=0,1.3=0,3\left(mol\right)\\ a,Mg+2HCl\rightarrow MgCl_2+H_2\\ Vì:\dfrac{0,1}{1}< \dfrac{0,3}{2}\Rightarrow HCldư\\ b,n_{H_2}=n_{MgCl_2}=n_{Mg}=0,1\left(mol\right)\\ n_{HCl\left(dư\right)}=0,3-0,1.2=0,1\left(mol\right)\\ b,V_{H_2\left(đktc\right)}=0,1.22,4=2,24\left(l\right)\\ c,C_{MddMgCl_2}=\dfrac{0,1}{0,1}=1\left(M\right)\\ C_{MddHCl\left(dư\right)}=\dfrac{0,1}{0,1}=1\left(M\right)\)
Đúng 0
Bình luận (0)
Cho chất sau lần lượt tác dụng với
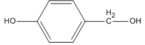
1. Na;
2. dung dịch NaOH;
3. dung dịch HBr;
4. CuO (đun nóng nhẹ).
Viết phương trình hoá học của các phản ứng xảy ra.
Bài 1: Viết phương trình hóa học khi cho dd HCl, dd H2SO4 loãng lần lượt tác dụng với: a) Magnesium b) Zinc
Bài 2: Cho một khối lượng mạt Iron (sắt) dư vào 50ml dung dịch sulfuric acid loãng. Phản ứng xong, thu được 3,36 lít khí hydrogen (đktc). a) Viết phương trình hóa học. b) Tính khối lượng mạt sắt đã tham gia phản ứng. c) Tính nồng độ mol của dung dịch sulfuric acid đã dùng.
giúp với
Đọc tiếp
Bài 1: Viết phương trình hóa học khi cho dd HCl, dd H2SO4 loãng lần lượt tác dụng với: a) Magnesium b) Zinc
Bài 2: Cho một khối lượng mạt Iron (sắt) dư vào 50ml dung dịch sulfuric acid loãng. Phản ứng xong, thu được 3,36 lít khí hydrogen (đktc). a) Viết phương trình hóa học. b) Tính khối lượng mạt sắt đã tham gia phản ứng. c) Tính nồng độ mol của dung dịch sulfuric acid đã dùng.
giúp với
Bài 1:
\(a)Mg+2HCl\rightarrow MgCl_2+H_2\\ Mg+H_2SO_4\rightarrow MgSO_4+H_2\\ b)Zn+2HCl\rightarrow ZnCl_2+H_2\\ Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
Bài 2:
\(a)Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ b)n_{H_2}=\dfrac{3,36}{22,4}=0,15mol\\ n_{Fe}=n_{H_2SO_4}=n_{H_2}=0,15mol\\ m_{Fe}=0,15.56=8,4g\\ c)C_{M_{H_2SO_4}}=\dfrac{0,15}{0,05}=3M\)
Đúng 2
Bình luận (0)
Cho tác dụng hoàn toàn m (g) CuO tác dụng với dung dịch HCl dư, thu được 200gam dung dịch muối đồng 13,5% Viết phương trình hóa học Tính m (g) CuO
\(PTHH:CuO+2HCl\to CuCl_2+H_2O\\ n_{CuCl_2}=\dfrac{200.13,5\%}{100\%.135}=0,2(mol)\\ \Rightarrow n_{CuO}=0,2(mol)\\ \Rightarrow m_{CuO}=0,2.80=16(g)\)
Đúng 2
Bình luận (0)
Giúp mình với
Cho 10g CuO tác dụng hoàn toàn với 500ml dung dịch HCl dư.
a) Viết phương trình hóa học của phản ứng?
b) Tính khối lượng Acid HCl đã phản ứng?
c) Tính nồng độ dung dịch CuCl 2 tạo thành?
PTHH: \(CuO+2HCl\rightarrow CuCl_2+H_2O\)
Ta có: \(n_{CuO}=\dfrac{10}{80}=0,125\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{HCl}=0,25\left(mol\right)\\n_{CuCl_2}=0,125\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{HCl}=0,25\cdot36,5=9,125\left(g\right)\\C_{M_{CuCl_2}}=\dfrac{0,125}{0,5}=0,25\left(M\right)\end{matrix}\right.\)
Đúng 2
Bình luận (1)
1) Viết phương trình phản ứng điều chế magie sunàt từ Mg(OH)2 và dung dịch axit sunfuric loãng 2) Có những chất sau: CuO, Mg, Al2O3, Fe(OH)3, Fe2O3. Chất nào tác dụng với HCl sinh ta dung dịch không có màu. 3) Viết phương trình hóa học giữa Magie oxit và axit nitric 4) Có 10g hỗn hợp bột hai kim loại Fe và Cu. Hãy nêu phương pháp xác định thành phần phần trăm (theo khối lượng) của mỗi kim loại trong hỗn hợp theo phương pháp hóa học và vật lý. Viết phương trình hóa học. (Biết Cu ko tác dụng với H...
Đọc tiếp
1) Viết phương trình phản ứng điều chế magie sunàt từ Mg(OH)2 và dung dịch axit sunfuric loãng
2) Có những chất sau: CuO, Mg, Al2O3, Fe(OH)3, Fe2O3. Chất nào tác dụng với HCl sinh ta dung dịch không có màu.
3) Viết phương trình hóa học giữa Magie oxit và axit nitric
4) Có 10g hỗn hợp bột hai kim loại Fe và Cu. Hãy nêu phương pháp xác định thành phần phần trăm (theo khối lượng) của mỗi kim loại trong hỗn hợp theo phương pháp hóa học và vật lý. Viết phương trình hóa học.
(Biết Cu ko tác dụng với HCl và H2SO4)
Bài 1)
Mg(OH)2 + H2SO4 => MgSO4 + 2H20
Bài 2)
sinh ra dd ko màu thì chỉ có Al2O3 thôi
Bài 3)
MgO + 2HNO3 => Mg(NO3)2 + H2O
Bài 4)
phương pháp hóa học
+ lấy hh Fe, Cu tác dụng với HCl
Fe +2 HCl => FeCl2 + H2
+ còn đồng ko tác dụng dc với HCl : ta lọc đồng ra khỏi hh òi phơi khô. Ta giả định cho đồng là 4g => mFe = 6g
% Cu = 4*100/10 = 40(%)
% Fe = 100- 40= 60 (%)
phương pháp vật lý
dùng nam châm hút sắt ra khỏi hỗn hợp. Ta có mFe là 6g => m Cu = 4 (g)
% Cu = 4*100/10 = 40(%)
% Fe = 100-40 = 60(%)
Đúng 0
Bình luận (0)
Dung dịch chứa những chất nào khi cho hỗn hợp CuO và F e 2 O 3 vào dung dịch HCl dư? Viết phương trình hóa học.
có 3 dung dịch đựng trong ba ống nghiệm riêng biệt Không nhãn gồm HCl KOH khco3 4 loãng hãy trình bày phương pháp hóa học để nhận biết từng dung dịch trong mỗi ống nghiệm nói trên và viết các phương trình hóa học của các phản ứng xảy ra nếu có
- Đun nóng (cô cạn) các dung dịch
+) Bay hơi hết: HCl
+) Bay hơi để lại chất rắn: KOH
+) Bay hơi để lại chất rắn và có khí thoát ra: KHCO3
PTHH: \(2KHCO_3\xrightarrow[t^o]{}K_2CO_3+H_2O+CO_2\uparrow\)
Đúng 4
Bình luận (0)
- Cho quỳ tím tác dụng với 3 dung dịch:
+ QT chuyển màu đỏ: HCl
+ QT chuyển màu xanh: KOH, KHCO3 (1)
- Cho HCl tác dụng với các dung dịch ở (1):
+ Không có hiện tượng: KOH
KOH + HCl --> KCl + H2O
+ Có khí không màu thoát ra: KHCO3
KHCO3 + HCl --> KCl + CO2 + H2O
Đúng 1
Bình luận (0)