Cách thu khí hiđro clorua trong phòng thí nghiệm.

Những câu hỏi liên quan
Trong phòng thí nghiệm có thể điều chế khí hiđro clorua bằng cách A. Cho NaCl tinh thể tác dụng với
H
2
S
O
4
đặc, đun nóng. B. Cho NaCl tinh thể tác dụng với
H
N
O
3
đặc, đun nóng. C. Cho NaCl tinh thể tác dụng với
H
2
S
O
4...
Đọc tiếp
Trong phòng thí nghiệm có thể điều chế khí hiđro clorua bằng cách
A. Cho NaCl tinh thể tác dụng với H 2 S O 4 đặc, đun nóng.
B. Cho NaCl tinh thể tác dụng với H N O 3 đặc, đun nóng.
C. Cho NaCl tinh thể tác dụng với H 2 S O 4 loãng, đun nóng.
D. Cho NaCl tinh thể tác dụng với H N O 3 loãng, đun nóng.
Chọn đáp án A
Trong phòng thí nghiệm, hiđro clorua được điều chế bằng cách cho NaCl tinh thể tác dụng với H 2 S O 4 đặc, đun nóng.
Đúng 0
Bình luận (0)
Các chất khí điều chế trong phòng thí nghiệm thường được thu theo phương pháp đẩy không khí (cách 1, cách 2) hoặc đẩy nước (cách 3, cách 4) như các hình vẽ dưới đây: Trong phòng thí nghiệm, có thể điều chế khí hiđro clorua bằng cách cho tinh thể NaCl tác dụng với axit
H
2
S
O
4
đậm đặc và đun nóng: Dùng cách nào trong bốn cách trên để thu khí HCl? A. Cách 1 B. Cách 2 C. Cách 3 D. Các...
Đọc tiếp
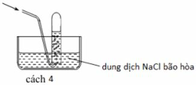
Các chất khí điều chế trong phòng thí nghiệm thường được thu theo phương pháp đẩy không khí (cách 1, cách 2) hoặc đẩy nước (cách 3, cách 4) như các hình vẽ dưới đây:
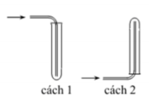
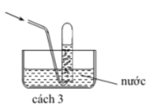
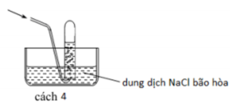
Trong phòng thí nghiệm, có thể điều chế khí hiđro clorua bằng cách cho tinh thể NaCl tác dụng với axit H 2 S O 4 đậm đặc và đun nóng:
![]()
![]()
Dùng cách nào trong bốn cách trên để thu khí HCl?
A. Cách 1
B. Cách 2
C. Cách 3
D. Cách 4
Các chất khí điều chế trong phòng thí nghiệm thường được thu theo phương pháp đẩy không khí (cách 1, cách 2) hoặc đẩy nước (cách 3, cách 4) như các hình vẽ dưới đây: Trong phòng thí nghiệm, có thể điều chế khí hiđro clorua bằng cách cho tinh thể NaCl tác dụng với axit
H
2
S
O
4
đậm đặc và đun nóng: NaOH+
H
2
S
O
4...
Đọc tiếp
Các chất khí điều chế trong phòng thí nghiệm thường được thu theo phương pháp đẩy không khí (cách 1, cách 2) hoặc đẩy nước (cách 3, cách 4) như các hình vẽ dưới đây:
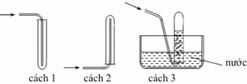
Trong phòng thí nghiệm, có thể điều chế khí hiđro clorua bằng cách cho tinh thể NaCl tác dụng với axit H 2 S O 4 đậm đặc và đun nóng:
NaOH+ H 2 S O 4 đ ặ c → t ∘ N a H S O 4 +HCl
Dùng cách nào trong bốn cách trên để thu khí HCl?
A. Cách 1
B. Cách 2
C. Cách 3
D. Cách 4
Hiđro clorua ( hcl ) là một chất khí được dùng để sản xuất axit clohiđric ( 1 trong các axit được dùng phổ biến trong phòng thí nghiệm ) . trong công nghiệp , hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo. Tính thể tích khí clo ( ở đktc ) cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro (ở đktc ) và khối lượng khí Hiđro clorua thu được sau phản ứng . Nêu nêu các bước giải bài toán tính theo phương trình hóa học .
Đọc tiếp
Hiđro clorua ( hcl ) là một chất khí được dùng để sản xuất axit clohiđric ( 1 trong các axit được dùng phổ biến trong phòng thí nghiệm ) . trong công nghiệp , hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo. Tính thể tích khí clo ( ở đktc ) cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro (ở đktc ) và khối lượng khí Hiđro clorua thu được sau phản ứng .
Nêu nêu các bước giải bài toán tính theo phương trình hóa học .
1. Tính khối lượng chất tham gia và sản phẩm
* Các bước giải:
- Đổi số liệu đầu bài. Tính số mol của chất mà đầu bài cho.
- Lập phương trình hoá học.
- Dựa vào số mol chất đã biết để tính số mol chất cần tìm.
2. Tính thể tích khí tham gia và tạo thành
H2+Cl2->2HCl
\(n_{H_2}=67,2:22,4=3\left(mol\right)\)
Ta có: \(n_{H_2}=n_{Cl_2}=3\left(mol\right)\)
\(V_{Cl_2}=3.22,4=67,2l\)
\(n_{HCl}=2n_{Cl_2}=2.3=6\left(mol\right)\)
\(m_{HCl}=6.36,5=219g\)
Đúng 0
Bình luận (0)
Hiđro clorua (HCl) là một chất khí được dùng để sản xuất axit clohiđric (một trong các axit được dùng phổ biến trong phòng thí nghiệm). Trong công nghiệp, hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo. Tính thể tích khí clo (ở điều kiện tiêu chuẩn ) cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro ( ở đktc) và khối lượng khí hiđro clorua thu được sau phản ứng.Nêu các bước giải bài toán theo phương trình hoá học.
Đọc tiếp
Hiđro clorua (HCl) là một chất khí được dùng để sản xuất axit clohiđric (một trong các axit được dùng phổ biến trong phòng thí nghiệm). Trong công nghiệp, hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo. Tính thể tích khí clo (ở điều kiện tiêu chuẩn ) cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro ( ở đktc) và khối lượng khí hiđro clorua thu được sau phản ứng.
Nêu các bước giải bài toán theo phương trình hoá học.
b1: viết pthh
cl2+ h2-> 2hcl
b2: tính số mol cá chất dựa vào khối lượng hoăc thể tích đề bài cho
nH2= 67,2/224=3 mol
b3: dựa vào phương trình tính số mol các chất còn lại
theo pthh: ncl2=nh2=3 mol
nhcl=2nh2=3*2=6 mol
b4: tính khối lượng hoặc thể tích chất đề bài yêu cầu
=> Vcl2= 3*22,4=67,2l
mhcl=6* 36,5= 219g
CHÚC BẠN HỌC TỐT!
Đúng 1
Bình luận (9)
Bước 1: Tìm số mol chất đã cho trong đề bài.
nH2 = VH2/22,4 = 67,2/22,4 = 3 (mol)
Bước 2: Viết PTHH, cân bằng.
H2 + Cl2 -> 2HCl
Bước 3: Từ hệ số trong PTHH => số mol chất cần tìm.
3 mol -> 3 mol -> 6 mol
Bước 4: Tính theo yêu cầu đề bài.
- VCl2 = nCl2 . 22,4 = 3 . 22,4 = 67,2 (lít)
* Bài giải hoàn chỉnh:
- nH2 = VH2/22,4 = 67,2/22,4 = 3 (mol)
- H2 + Cl2 -> 2HCl
- 3 mol -> 3 mol -> 6 mol
- VCl2 = nCl2 . 22,4 = 3 . 22,4 = 67,2 (lít)
- mHCl = nHCl . MHCl = 6 . 36,5 = 219 (g)
Nếu bạn nào thắc mắc về câu trả lời của mk hay không hiểu chỗ nào, cứ việc bình luận. Mk sẽ nói rõ hơn! Mơn nhìu! >3<
Đúng 0
Bình luận (1)
Hiđro clorua (HCl) là một chất khí được dùng để sản xuất axit clohiđric (một trong các axit được dùng phổ biến trong phòng thí nghiệm). Trong công nghiệp, hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo. Tính thể tích khí clo (ở điều kiện tiêu chuẩn ) cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro ( ở đktc) và khối lượng khí hiđro clorua thu được sau phản ứng.Nêu các bước giải bài toán theo phương trình hoá học.
Đọc tiếp
Hiđro clorua (HCl) là một chất khí được dùng để sản xuất axit clohiđric (một trong các axit được dùng phổ biến trong phòng thí nghiệm). Trong công nghiệp, hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo. Tính thể tích khí clo (ở điều kiện tiêu chuẩn ) cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro ( ở đktc) và khối lượng khí hiđro clorua thu được sau phản ứng.
Nêu các bước giải bài toán theo phương trình hoá học.
Có: nH2= 67,2:22,4=3(mol)
PTPƯ: H2 + Cl2 --to--> 2 HCl
(mol) 1 1 2
(mol) 3 3 6
(l) 67,2 67,2 134,4
(g) 6 213 219
Đúng 0
Bình luận (0)
Bước 1: Viet PTHH
H2 + Cl2 \(\rightarrow\) 2HCl
Bước 2: Ta tính số mol các chất đã cho theo gia thiết
Số mol H2 la
\(n_{H_2}=\)\(V_{H_2}\): 22,4= 67,2 : 22,4 = 3 (mol)
Bước 3: Dựa vào PTHH, ta có thể tính số mol các chất còn lại
Theo PTHH: \(n_{H_2=}2n_{HCl}=3\cdot2=6\left(mol\right)\)
Bước 4: Tính khối lượng (m) hay thể tích (V) các chất cần tìm.
Thể tích Cl cần dùng là
\(V_{Cl}=n_{Cl}\cdot22,4=3\cdot22,4=67,2\left(l\right)\)
Khối lượng HCl thu được là
\(m_{HCl}=M_{HCl}\cdot n_{HCl}=36,5\cdot6=219\left(g\right)\)
Chúc bạn học giỏi.![]()
Đúng 0
Bình luận (0)
Trong phòng thí nghiệm, để điều chế khí hiđro clorua, người ta dùng A. dung dịch NaCl tác dụng với H2SO4 B. điện phân dung dịch NaCl không có màng ngăn C. cho H2SO4 đặc, nóng tác dụng với NaCl khan D. KMnO4 tác dụng với HCl đặc
Đọc tiếp
Trong phòng thí nghiệm, để điều chế khí hiđro clorua, người ta dùng
A. dung dịch NaCl tác dụng với H2SO4
B. điện phân dung dịch NaCl không có màng ngăn
C. cho H2SO4 đặc, nóng tác dụng với NaCl khan
D. KMnO4 tác dụng với HCl đặc
Đáp án C
Trong phòng thí nghiệm, khí HCl (hiđro clorua) được điều chế bằng cách cho NaCl rắn tác dụng với H2SO4 đặc, đun nóng:
N a C l ( r ắ n ) + H 2 S O 4 ( đ ặ c ) → t 0 N a H S O 4 + H C l ↑ N a C l ( r ắ n ) + H 2 S O 4 ( đ ặ c ) → t 0 N a 2 S O 4 + 2 H C l ↑
Đúng 0
Bình luận (0)
Hiđro clorua {Hcl}là một chất khí được dùng để sản xuất axit clohiđric{một trong các axit được dùng phổ biến trong phòng thí nghiệm }.Trong công nghiệp , hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo.Tính thể tích khí clo {ở đktc}cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro{ở đktc}và khối lượng khí hiđro clorua thu được sau phản ứng .Nêu các bước giải bài toán tính theo phương trình hóa học . GIÚP MÌNH NHA ! CẢM ƠN CÁC BẠN !
Đọc tiếp
Hiđro clorua {Hcl}là một chất khí được dùng để sản xuất axit clohiđric{một trong các axit được dùng phổ biến trong phòng thí nghiệm }.Trong công nghiệp , hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo.Tính thể tích khí clo {ở đktc}cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro{ở đktc}và khối lượng khí hiđro clorua thu được sau phản ứng .
Nêu các bước giải bài toán tính theo phương trình hóa học .
![]() GIÚP MÌNH NHA ! CẢM ƠN CÁC BẠN !
GIÚP MÌNH NHA ! CẢM ƠN CÁC BẠN !
nH2= 67.2/22.4=3 mol
PTHH: H2 + Cl2 --> 2HCl
3mol 3 mol 6 mol
VCl2=3*22.4=67.2 lít
mHCl=6*36.5=219g
Chúc em học tốt !!@@
Đúng 0
Bình luận (0)
[1]. Trong phòng thí nghiệm người ta dùng 2,7g nhôm tác dụng với dung dịch axit clohiđric sinh ra nhôm clorua và khí hiđro thoát ra.
A. Viết phương trình phản ứng
B. Thể tích khí hiđro thu được (đktc)
C. Tính khối lượng axit clohiđric cần dùng.
_______________________________________________
[2]. Cho 2,3g natri tác dụng với nước sinh ra natri hiđroxit và khí hiđro
A. Viết phương trình phản ứng.
B. Thể tích khí hiđro thu được.
C. Tính khối lượng natri hiđroxit tạo thành.
Đọc tiếp
[1]. Trong phòng thí nghiệm người ta dùng 2,7g nhôm tác dụng với dung dịch axit clohiđric sinh ra nhôm clorua và khí hiđro thoát ra. A. Viết phương trình phản ứng B. Thể tích khí hiđro thu được (đktc) C. Tính khối lượng axit clohiđric cần dùng. _______________________________________________ [2]. Cho 2,3g natri tác dụng với nước sinh ra natri hiđroxit và khí hiđro A. Viết phương trình phản ứng. B. Thể tích khí hiđro thu được. C. Tính khối lượng natri hiđroxit tạo thành.
Bài 1 :
a. \(n_{Al}=\dfrac{2.7}{27}=0,1\left(mol\right)\)
PTHH : 2Al + 6HCl -> 2AlCl3 + 3H2
0,1 0,3 0,15
b. \(V_{H_2}=0,15.22,4=3,36\left(l\right)\)
c. \(m_{HCl}=0,3.36,5=10,95\left(g\right)\)
Bài 2 :
a. \(n_{Na}=\dfrac{2.3}{23}=0,1\left(mol\right)\)
PTHH : 2Na + 2H2O -> 2NaOH + H2
0,1 0,1 0,05
b. \(V_{H_2}=0,05.22,4=1,12\left(l\right)\)
c. \(m_{NaOH}=0,1.40=4\left(g\right)\)
Đúng 3
Bình luận (0)
Có thể thu những khí nào vào bình (từ những thí nghiệm trong phòng thí nghiệm) khí hiđro, khí clo, khí cacbon đioxit, khí metan bằng cách:
a) Đặt đứng bình.
b) Đặt ngược bình.
Giải thích việc làm này?
Ta có:
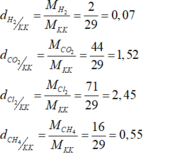
a) Đặt ngửa bình thu được những khí có tỉ khối đối với không khí lớn hơn 1
- Khí clo nặng hơn không khí 2,45 lần
- Khí cacbon đioxit nặng hơn không khí 1,52 lần
b) Đặt úp bình thu được những khí còn lại có tỉ khối đối với không khí nhỏ hơn 1:
- Khí hiđro nhẹ hơn không khí và bằng 0,07 lần không khí
- Khí metan CH4 nhẹ hơn không khí và bằng 0,55 lần không khí.
Đúng 0
Bình luận (0)
















