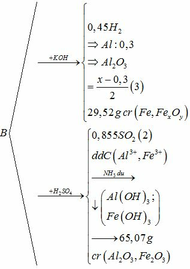
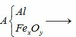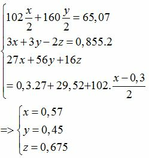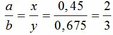Chia 22,59g hỗn hợp E1 gồm Fe và kim loại M (có hóa trị không đổi) làm 3phần bằng nhau .Hòa tan hết phần 1 bằng dd HCl thì thu được 3.696lít khí H2 .Phần 2 tác dụng hoàn toàn với dd H2SO4 đặc nóng dư thì thu được 5,04lít khí SO2 (sản psản khử duy nhất )
1.viết các ptpư xảy ra và xác định M biết các khí đó ở đktc
2.Cho phần 3 vào 100ml dd Cu(NO3)2 phản ứng hoàn toàn thu được chất rắn E2 có khối lượng 9,76g . Viết các ptpư xảy ra và tính CM của dd Cu(NO3)2