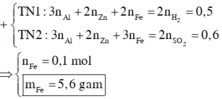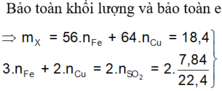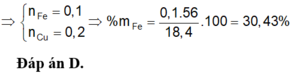hòa tan 23,8g hỗn hợp gồm Al và Zn bằng H2SO4 đặc nóng thu được 14,232 lít SO2 (đktc) 1,28g S và dung dịch X. Xác định khối lượng trong dung dịch X

Những câu hỏi liên quan
Hoà tan hoàn toàn 11,9 gam hỗn hợp gồm Al và Zn bằng H2SO4 đặc nóng thu được 7,616 lít SO2 (đktc), 0,64 gam S và dung dịch X. Khối lượng muối trong dung dịch X là A. 50,3 gam. B. 30,5 gam. C. 35,0 gam. D. 30,05 gam.
Đọc tiếp
Hoà tan hoàn toàn 11,9 gam hỗn hợp gồm Al và Zn bằng H2SO4 đặc nóng thu được 7,616 lít SO2 (đktc), 0,64 gam S và dung dịch X. Khối lượng muối trong dung dịch X là
A. 50,3 gam.
B. 30,5 gam.
C. 35,0 gam.
D. 30,05 gam.
Đáp án A
Số mol các chất là:
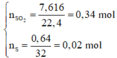
Sơ đồ phản ứng:
Al Zn ⏟ 11 , 9 g a m + H 2 S O 4 ( đ ặ c ) → Al 2 ( SO 4 ) 3 ZnSO 4 ⏟ M u ố i + S O 2 ⏟ 0 , 34 mol S ⏟ 0 , 02 m o l + H 2 o
Áp dụng công thức của bài toán kim loại tác dụng với H2SO4 đặc ta có:
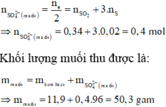
Đúng 0
Bình luận (0)
Hỗn hợp X gồm Al, Zn và Fe. Cho m gam hỗn hợp X tác dụng với H2SO4 loãng, dư thu được 5,6 lít H2 (đktc). Mặt khác, khi hòa tan hoàn toàn X trong dung dịch H2SO4 đặc, nóng dư thu được 6,72 lít SO2 (đktc). Tính khối lượng Fe có trong m gam hỗn hợp X A. 5,6 gam B. 8,4 gam C. 6,72 gam D. 2,8 gam
Đọc tiếp
Hỗn hợp X gồm Al, Zn và Fe. Cho m gam hỗn hợp X tác dụng với H2SO4 loãng, dư thu được 5,6 lít H2 (đktc). Mặt khác, khi hòa tan hoàn toàn X trong dung dịch H2SO4 đặc, nóng dư thu được 6,72 lít SO2 (đktc). Tính khối lượng Fe có trong m gam hỗn hợp X
A. 5,6 gam
B. 8,4 gam
C. 6,72 gam
D. 2,8 gam
Đáp án : A
nH2 = 0,25 mol; nSO2 = 0,3 mol
2H+ + 2e → H2 S+6 + 2e → S+4
0,5 <-- 0,25 0,6 <-- 0,3
nFe = 0,6 – 0,5 = 0,1 mol
=> mFe = 5,6g
Đúng 0
Bình luận (0)
Hỗn hợp X gồm Al, Zn và Fe. Cho m gam hỗn hợp X tác dụng với H2SO4 loãng dư, thu được 5,6 lít H2 (đktc). Mặt khác, khi hòa tan hoàn toàn X trong dung dịch H2SO4 đặc nóng (dư), thu được 6,72 lít SO2 (đktc). Khối lượng Fe có trong m gam hỗn hợp X là A. 5,6 gam. B. 8,4 gam. C. 6,72 gam. D. 2,8 gam.
Đọc tiếp
Hỗn hợp X gồm Al, Zn và Fe. Cho m gam hỗn hợp X tác dụng với H2SO4 loãng dư, thu được 5,6 lít H2 (đktc). Mặt khác, khi hòa tan hoàn toàn X trong dung dịch H2SO4 đặc nóng (dư), thu được 6,72 lít SO2 (đktc). Khối lượng Fe có trong m gam hỗn hợp X là
A. 5,6 gam.
B. 8,4 gam.
C. 6,72 gam.
D. 2,8 gam.
Hòa tan 18,4 gam hỗn hợp X gồm Fe và Cu trong dung dịch H2SO4 đặc, nóng dư thu được 7,84 lít SO2 (đktc) và dung dịch Y. Phần trăm khối lượng của Fe trong hỗn hợp X là: A. 60,87%. B. 45,65%. C. 53,26%. D. 30,43%.
Đọc tiếp
Hòa tan 18,4 gam hỗn hợp X gồm Fe và Cu trong dung dịch H2SO4 đặc, nóng dư thu được 7,84 lít SO2 (đktc) và dung dịch Y. Phần trăm khối lượng của Fe trong hỗn hợp X là:
A. 60,87%.
B. 45,65%.
C. 53,26%.
D. 30,43%.
Đáp án D.
Gọi nCu = y, nFe = x mol

Áp dụng định luật bảo toàn e ta có: 3x+2y = 0,7 (1)
Khối lượng hai kim loại = 1,84 g: 56x+64y = 184 (2).
Giải 1,2 ta có: x = 0,1, y = 0,2 (mol)
% m F e = 0 , 1 . 56 18 , 4 . 100 % = 30 , 43 %
Đúng 0
Bình luận (0)
Hòa tan 18,4 gam hỗn hợp X gồm Fe và Cu trong dung dịch H2SO4 đặc, nóng dư thu được 7,84 lít SO2 (đktc) và dung dịch Y. Phần trăm khối lượng của Fe trong hỗn hợp X là: A. 60,87% B. 45,65% C. 53,26% D. 30,43%
Đọc tiếp
Hòa tan 18,4 gam hỗn hợp X gồm Fe và Cu trong dung dịch H2SO4 đặc, nóng dư thu được 7,84 lít SO2 (đktc) và dung dịch Y. Phần trăm khối lượng của Fe trong hỗn hợp X là:
A. 60,87%
B. 45,65%
C. 53,26%
D. 30,43%
Hòa tan hoàn toàn 49,6 gam hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4 bằng H2SO4 đặc, nóng thu được dung dịch Y và 8,96 lít khí SO2 (đktc). Thành phần phần trăm về khối lượng của oxi trong hỗn hợp X và khối lượng muối trong dung dịch Y lần lượt là
Coi X gồm Fe và O.
Ta có: 56nFe + 16nO = 49,6 (1)
\(n_{SO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
BT e, có: 3nFe - 2nO = 2nSO2 = 0,8 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,7\left(mol\right)\\n_O=0,65\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_O=\dfrac{0,65.16}{49,6}.100\%\approx20,97\%\)
Muối thu được là Fe2(SO4)3
BTNT Fe, có: \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe}=0,35\left(mol\right)\)
\(\Rightarrow m_{Fe_2\left(SO_4\right)_3}=0,35.400=140\left(g\right)\)
Đúng 4
Bình luận (0)
Cho 33,2g hỗn hợp X gồm Cu, Mg, Al tác dụng vừa đủ với dung dịch H2SO4 loãng thu được 22,4 lít khí ở đktc và chất rắn không tan B. Cho B hoà tan hoàn toàn vào dung dịch H2SO4 đặc, nóng dư thu được 4,48 lít khí SO2(đktc). Khối lượng mỗi kim loại trong hỗn hợp X lần lượt là: A. 13,8;7,6;11,8 B. 11,8;9,6;11,8 C. 12,8;9,6;10,8 D. kết quả khác
Đọc tiếp
Cho 33,2g hỗn hợp X gồm Cu, Mg, Al tác dụng vừa đủ với dung dịch H2SO4 loãng thu được 22,4 lít khí ở đktc và chất rắn không tan B. Cho B hoà tan hoàn toàn vào dung dịch H2SO4 đặc, nóng dư thu được 4,48 lít khí SO2(đktc). Khối lượng mỗi kim loại trong hỗn hợp X lần lượt là:
A. 13,8;7,6;11,8
B. 11,8;9,6;11,8
C. 12,8;9,6;10,8
D. kết quả khác
Đáp án C.
Kim loại không phản ứng với H2SO4 loãng là Cu.
Gọi nCu = x, nMg = y, nAl = z
Ta có:
64x + 24y + 27z = 33,2 (1)
Bảo toàn e:
2nMg + 3nAl = 2nH2
=> 2y + 3z = 2.1 (2)
2nCu = 2nSO2 => x = 0.2 (mol) (3)
Từ 1, 2, 3 => x = 0,2; y = z = 0,4 (mol)
mCu = 0,2.64 = 12,8 (g)
mMg = 0,4.24 = 9,6 (g)
mAl = 10,8 (g)
Đúng 0
Bình luận (0)
Hỗn hợp X gồm Mg, Zn, Cu và Al. Cho 14,7 gam X tác dụng với một lượng dư dung dịch HCl thu được 10,08 lít khí H2. Nếu hòa tan 14,7 gam X bằng một lượng dư dung dịch H2SO4 đặc, nóng thì thu được 10,64 lít khí SO2 (sản phẩm khử duy nhất ). Biết thể tích các khí đều đo ở đktc, các phản ứng xảy ra hoàn toàn. Tính phần trăm khối lượng của Cu có trong X .
Đọc tiếp
Hỗn hợp X gồm Mg, Zn, Cu và Al. Cho 14,7 gam X tác dụng với một lượng dư dung dịch HCl thu được 10,08 lít khí H2. Nếu hòa tan 14,7 gam X bằng một lượng dư dung dịch H2SO4 đặc, nóng thì thu được 10,64 lít khí SO2 (sản phẩm khử duy nhất ). Biết thể tích các khí đều đo ở đktc, các phản ứng xảy ra hoàn toàn. Tính phần trăm khối lượng của Cu có trong X .
Giả sử: \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\\n_{Cu}=c\left(mol\right)\\n_{Al}=d\left(mol\right)\end{matrix}\right.\)
_ Khi tác dụng với HCl.
Ta có: \(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
Theo ĐLBT mol e, có: 2a + 2b + 3d = 0,45.2 ⇒ 2a + 2b + 3d = 0,9 (1)
_ Khi tác dụng với H2SO4 đặc nóng.
Ta có: \(n_{SO_2}=\dfrac{10,64}{22,4}=0,475\left(mol\right)\)
Theo ĐLBT mol e, có: 2a + 2b + 2c + 3d = 0,475.2
⇒ 2a + 2b - 2c + 3d = 0,95 (2)
Trừ 2 vế của (1) và (2), có: c = 0,025 (mol)
\(\Rightarrow\%m_{Cu}=\dfrac{0,025.64}{14,7}.100\%\approx10,88\%\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (0)
Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\\n_{Cu}=c\left(mol\right)\\n_{Al}=d\left(mol\right)\end{matrix}\right.\)
Ta có: \(\left\{{}\begin{matrix}n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\\n_{SO_2}=\dfrac{10,64}{22,4}=0,475\left(mol\right)\end{matrix}\right.\)
Bảo toàn electron: \(\left\{{}\begin{matrix}2a+2b+2c+3d=0,475\cdot2\\2a+2b+3d=0,45\cdot2\end{matrix}\right.\)
\(\Rightarrow2c=0,475\cdot2-0,45\cdot2=0,05\) \(\Rightarrow c=0,025\)
\(\Rightarrow\%m_{Cu}=\dfrac{0,025\cdot64}{14,7}\cdot100\%\approx10,88\%\)
Đúng 1
Bình luận (0)
Hoà tan hoàn toàn 8,5 gam hỗn hợp Zn, Mg bằng dung dịch H2SO4 đặc thu được 1,12 lít SO2 (ở đktc) và 1,6 gam S và dung dịch X. Khối lượng muối khan trong dung dịch X là
Từ n SO2 = 1,12/22,4 = 0,05 mol và n S = 1,6/32 = 0,05 mol
--> m muối = 8,5 + 96(0,05 + 0,05 x 3) = 27,7 gam.
Đúng 0
Bình luận (0)