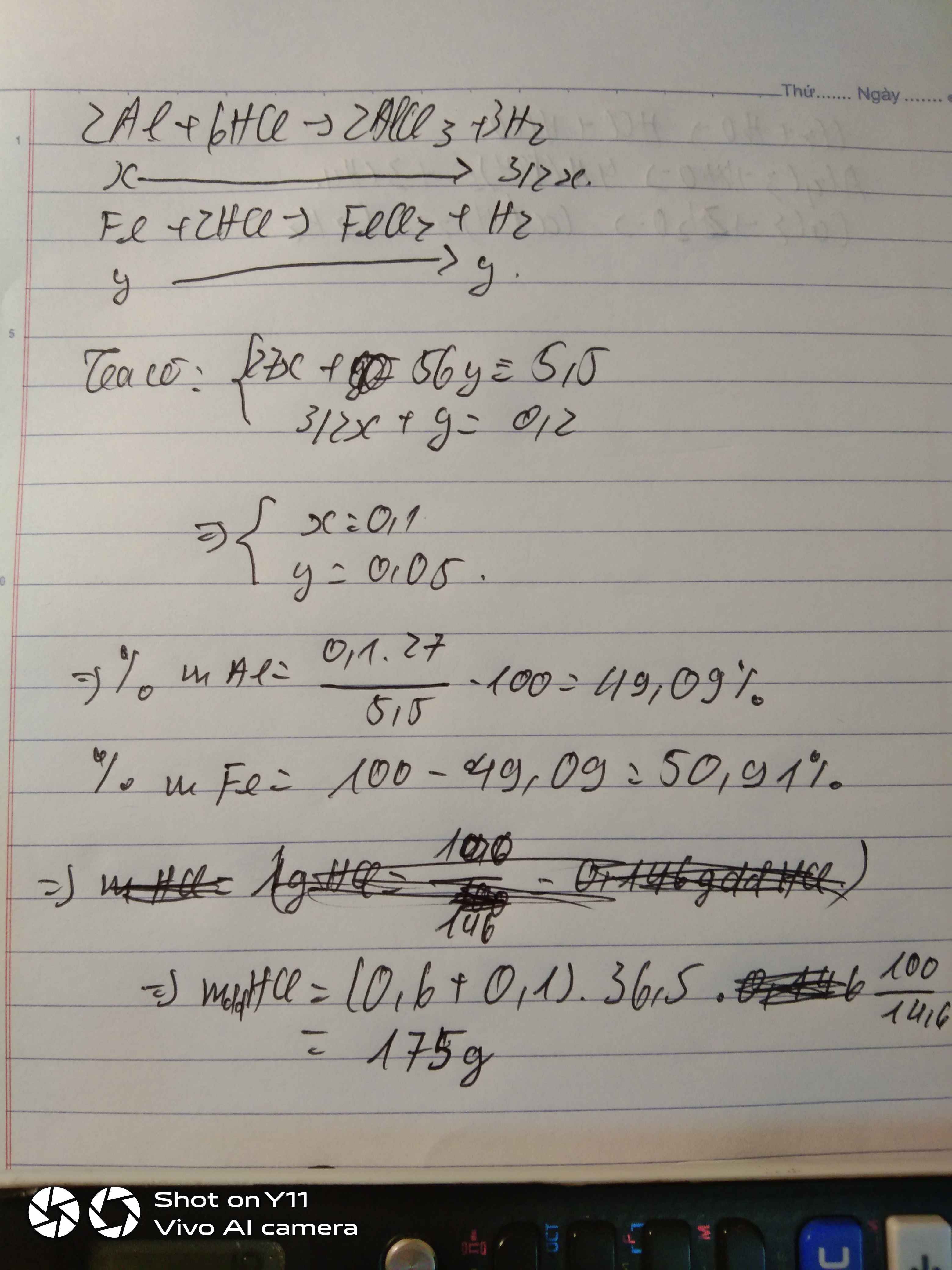Hòa tan hoàn toàn 11,9 hỗn hợp 2 kim loại Al và Zn cần vừa đủ 400ml dung dịch H2SO4 loãng thì thu được 8,96l khí hidro (dktc)
a. Tính thành phần phần trăm về khối lượng của mỗi kim loại trong hỗn hợp
b. Nếu cho hỗn hợp 2 kim loại trên tác dụng với dung dịch H2SO4 đặc nóng. Tính thể tích khí SO2 ( sản phẩm khử duy nhất) thu được ở đktc