Đốt cháy 100 lít khí tự nhiên chứa 95% CH4, 2% N2 và 3% CO2. Tính thể tích khí CO2 thu được phản ứng

Những câu hỏi liên quan
đốt cháy 56 lít khí thiên nhiên chứa 95% CH4, 2% N2 và 2% CO2 về thể tích.tính thể tích co2 sau phản ứng
giúp vs ạ
Đốt cháy 8,96 lít khí CH4 trong không khí đến khi phản ứng xảy ra hoàn toàn.
a, Tính thể tích khí CO2 thoát ra ở đktc
b, Nếu cho 8,96 lít khí CH4 trên vào bình chứa 8,96 lít khí O2 đktc nung hỗn hợp để phản ứng xảy ra hoàn toàn. Tính thể tích khí CO2 thu được ở đktc
a) \(n_{CH_4}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,4---------------->0,4
=> \(V_{CO_2}=0,4.22,4=8,96\left(l\right)\)
b) \(n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Xét tỉ lệ \(\dfrac{0,4}{1}>\dfrac{0,4}{2}\) => CH4 dư, O2 hết
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,4-------->0,2
=> \(V_{CO_2}=0,2.22,4=4,48\left(l\right)\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn V(lit) khi thiên nhiên ( có chứa 90% CH4 :5% C2H4,và 5% C2H8) cần dùng vừa đủ 246,4lit không khí ( có chứa 80% N2 và 20% O2) thu được khí CO2 và H2O
a) Tìm V?
b) Tính thể tích hỗn hợp khí thu được sau phản ứng
Biết các khí được đo ở cùng điều kiện về nhiệt độ và áp suất.
a) Giả sử các khí được đo ở điều kiện sao cho 1 mol khí chiếm thể tích 1 lít
Gọi số mol hỗn hợp khí là a (mol) => \(\left\{{}\begin{matrix}n_{CH_4}=0,9a\left(mol\right)\\n_{C_2H_4}=0,05a\left(mol\right)\\n_{C_3H_8}=0,05a\left(mol\right)\end{matrix}\right.\)
\(n_{O_2}=\dfrac{246,4.20\%}{1}=49,28\left(mol\right)\)
=> \(n_{N_2}=\dfrac{246,4}{1}-49,28=197,12\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,9a->1,8a---->0,9a--->1,8a
C2H4 + 3O2 --to--> 2CO2 + 2H2O
0,05a->0,15a------>0,1a-->0,1a
C3H8 + 5O2 --to--> 3CO2 + 4H2O
0,05a-->0,25a----->0,15a-->0,2a
=> 1,8a + 0,15a + 0,25a = 49,28
=> a = 22,4 (mol) => V = 22,4.1 = 22,4 (l)
b) Sau phản ứng thu được \(\left\{{}\begin{matrix}N_2:197,12\left(mol\right)\\CO_2:25,76\left(mol\right)\\H_2O:47,04\left(mol\right)\end{matrix}\right.\)
- Nếu H2O ở thể lỏng
=> hh khí gồm N2, CO2
=> \(V_{hh}=\left(197,12+25,76\right).1=222,88\left(l\right)\)
- Nếu H2O ở thể khí
=> hh gồm N2, CO2, H2O
=> \(V_{hh}=\left(197,12+25,76+47,04\right).1=269,92\left(l\right)\)
Đúng 1
Bình luận (0)
Khí mêtan CH4 có trong tự nhiên hoặc trong khí bioga, khí mêtan cháy trong không khí sinh ra khí (CO2) và nước (H2O). Hãy:
a. Viết phương trình phản ứng xảy ra
b. Tính thể tích khí CO2 (đktc) thu được sau khi đốt cháy hoàn toàn 3,36lít khí mêtan ( đktc).
Xem chi tiết
a) PTHH: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
b) Vì trong chất khí, tỉ lệ về số mol cũng chính là tỉ lệ về thể tích
\(\Rightarrow V_{CH_4}=V_{CO_2}=3,36\left(l\right)\)
Đúng 1
Bình luận (0)
Khi đốt 100 lít khí thiên nhiên chứa 96% CH4 2% n2 2% CO2 về số mol thể tích khí CO2 thải vào không khí là bao nhiêu oh
Xem chi tiết
\(V_{CH_4} = 100.96\% = 96(lít)\\ V_{CO_2} = 100.2\% = 2(lít)\\ CH_4 + O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ \)
Ta có :
\(V_{CO_2\ thải\ ra} = V_{CH_4} + V_{CO_2} = 96 + 2 = 98(lít)\)
Đúng 1
Bình luận (0)
\(\%V_{CH_4}=96\left(l\right)\)
\(CH_4+O_2\rightarrow CO_2+2H_2O\)
- Thấy cứ 1l CH4 tạo ra 1l CO2
=> 96l CH4 tạo ra x l CO2 .
=> X = 96 ( l )
Vậy cứ đốt 100 lít khí thiên nhiên sẽ thải ra 96l khí CO2
Đúng 0
Bình luận (0)
đốt cháy 25 lít hỗn hợp khí a gồm ch4 và c2h6 trong bình đựng 95 lít khí o2. sau phản ứng thu được 60 lít hỗn hợp khí b gồm co2 và o2. tỉ khối của hỗn hợp khí tạo thành so với h2 là 20,5. Tính thành phần % thể tích hỗn hợp ban đầu. Tính tỉ khối của A so với B
Giả sử các khí được đo ở điều kiện sao cho 1 mol khí chiếm thể tích 1 lít
Gọi số mol CH4, C2H6 là a, b (mol)
=> \(a+b=\dfrac{25}{1}=25\left(mol\right)\) (1)
\(n_{O_2}=\dfrac{95}{1}=95\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
a---->2a---------->a
2C2H6 + 7O2 --to--> 4CO2 + 6H2O
b------>3,5b-------->2b
=> \(\left\{{}\begin{matrix}n_{O_2\left(dư\right)}=95-2a-3,5b\left(mol\right)\\n_{CO_2}=a+2b\left(mol\right)\end{matrix}\right.\)
=> \(95-a-1,5b=\dfrac{60}{1}=60\)
=> a + 1,5b = 35 (2)
(1)(2) => a = 5; b = 20
=> \(\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{5}{25}.100\%=20\%\\\%V_{C_2H_6}=\dfrac{20}{25}.100\%=80\%\end{matrix}\right.\)
\(\overline{M}_A=\dfrac{5.16+20.30}{5+20}=27,2\left(g/mol\right)\)
\(\overline{M}_B=20,5.2=41\left(g/mol\right)\)
=> \(d_{A/B}=\dfrac{27,2}{41}\approx0,663\)
Đúng 1
Bình luận (0)
Khi đốt 1 lít khí thiên nhiên chứa 96% CH4 2% n2 2% CO2 và số mol thể tích khí CO2 thải vào không khí là bao nhiêu
Xem chi tiết
VCH4 = 0.96 (l)
VCO2 = 0.02 (l)
CH4 + 2O2 -to-> CO2 + H2O
VCO2 = 0.96 + 0.02 = 0.98 (l)
Đúng 0
Bình luận (0)
Một loại khí thiên nhiên có thành phần về thể tích như sau:85%
C
H
4
; 10%
C
2
H
6
; 3%
N
2
; 2%
C
O
2
.1. Người ta chuyển metan trong 1000
m
3
(đktc) khí thiên nhiên đó thành axetilen (hiệu suất 50%) rồi thành vinyl clorua (hiệu...
Đọc tiếp
Một loại khí thiên nhiên có thành phần về thể tích như sau:
85% C H 4 ; 10% C 2 H 6 ; 3% N 2 ; 2% C O 2 .
1. Người ta chuyển metan trong 1000 m 3 (đktc) khí thiên nhiên đó thành axetilen (hiệu suất 50%) rồi thành vinyl clorua (hiệu suất 80%). Viết phương trình hoá học của các phản ứng và tính khối lượng vinyl clorua thu được.
2. Người ta đốt cháy hoàn toàn khí thiên nhiên đó để đun nóng 100 lít nước từ 20 ° C lên 100 ° C . Tính thể tích khí thiên nhiên (đktc) cần đốt, biết rằng nhiệt lượng toả ra khi đốt cháy 1 mol CH4 và 1 mol C 2 H 6 lần lượt là 880 kJ và 1560 kJ ; để làm cho lml nước tăng thêm 1 ° cần 4,18 J và khi đốt khí thiên nhiên, 20% nhiệt lượng toả ra môi trường không khí.
1. Trong 1000 m 3 khí thiên nhiên có 850 m 3 C H 4
2 C H 4 → 1500 ° C C 2 H 2 + 3 H 2
CH ≡ CH + HCl → 150 - 200 ° C , H g C l 2 C H 2 = C H - C l
Khối lượng vinyl clorua thu được (nếu hiệu suất các quá trình là 100%) là:
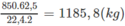
Với hiệu suất cho ở đầu bài, khối lượng vinyl clorua là:
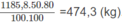
2. Nhiệt lượng cần dùng để làm nóng 100 lít nước từ 20 ° C lên 100 ° C :
100.4,18.(100 - 20) = 33440 (kJ)
Vì 20% nhiệt lượng đã toả ra môi trường nên nhiệt lượng mà khí thiên nhiên cần cung cấp phải là :
Đặt số mol C 2 H 6 tà x thì số mol C H 4 là 85. 10 - 1 x.
Ta có 1560x + 88085. 10 - 1 x = 41800
x = 462. 10 - 2
Thể tích khí thiên nhiên cần dùng:
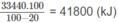
Đúng 0
Bình luận (0)
Đốt cháy khí metan theo sơ đồ phản ứng : CH4 + O2 ---> CO2 + H2O
Tính thể tích khí O2 ; CO2 ; hơi H2O khi đốt chyá hết 20 lít CH4.
Các thể tích đo cùng điều kiện nhiệt độ và áp suất.
a, Tính thể tích của oxi (đktc) cần dùng để đốt cháy hết 3,1 gam P, biết phản ứng sinh ra chất rắn P2O5.
b, Đốt cháy hoàn toàn 1,12 lít khí CH4 (đktc) cần dùng V lít khí O2 (đktc), sau phản ứng thu được sản phẩm là khí cacbonic (CO2) và nước (H2O). Giá trị của V là
a, Theo giả thiết ta có: \(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
\(4P+5O_2--t^o->2P_2O_5\)
Ta có: \(n_{O_2}=\dfrac{5}{4}.n_P=0,125\left(mol\right)\Rightarrow V_{O_2\left(đktc\right)}=0,125.22,4=2,8\left(l\right)\)
b, Theo giả thiết ta có: \(n_{CH_4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
\(CH_4+2O_2--t^o->CO_2+2H_2O\)
Ta có: \(n_{O_2}=2.n_{CH_4}=0,1\left(mol\right)\Rightarrow V_{O_2\left(đktc\right)}=2,24\left(l\right)\)
Đúng 1
Bình luận (0)




















