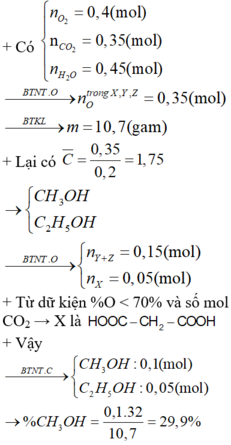Tính khối lượng của hỗn hợp gồm 0,2 SO2 và 8,96 lit CH4 ở đktc

Những câu hỏi liên quan
Cho 56 gam hỗn hợp A gồm K2CO3, Na2CO3, K2SO3 tác dụng với dung dịch HCl vừa đủ thu được 8,96 lit hỗn hợp khí gồm CO2 và SO2 có tỉ khối so với H2 là 27 (ĐKTC) a. Tính thể tích mỗi khí CO2 và SO2 thu được b. Tính khối lượng mỗi chất trong hỗn hợp A biếtK2CO3 + HCl ® KCl + CO2 + H2ONa2CO3 + HCl ® NaCl + CO2 + H2OK2SO3 + HCl ® KCl + SO2 + H2O
Đọc tiếp
Cho 56 gam hỗn hợp A gồm K2CO3, Na2CO3, K2SO3 tác dụng với dung dịch HCl vừa đủ thu được 8,96 lit hỗn hợp khí gồm CO2 và SO2 có tỉ khối so với H2 là 27 (ĐKTC)
a. Tính thể tích mỗi khí CO2 và SO2 thu được
b. Tính khối lượng mỗi chất trong hỗn hợp A biết
K2CO3 + HCl ® KCl + CO2 + H2O
Na2CO3 + HCl ® NaCl + CO2 + H2O
K2SO3 + HCl ® KCl + SO2 + H2O
a) Gọi $n_{CO_2} = a(mol) ; n_{SO_2} = b(mol)$
Ta có :
$a + b = \dfrac{8,96}{22,4} = 0,4(mol)$
$\dfrac{44a + 64b}{a + b} = 27.2$
Suy ra : a = b = 0,2$
$V_{CO_2} = V_{SO_2} = 0,2.22,4 = 4,48(lít)$
b) Theo PTHH : $n_{K_2SO_3} = n_{SO_2} = 0,2(mol)$
$\Rightarrow m_{K_2SO_3} = 0,2.158 = 31,6(gam)$
Gọi $n_{K_2CO_3} = x(mol) ; n_{Na_2CO_3} = y(mol)$
$\Rightarrow 138x + 106y + 31,6 = 56(1)$
$n_{CO_2} = x + y = 0,2(2)$
Từ (1)(2) suy ra : x = y = 0,1
$m_{K_2CO_3} = 0,1.138 = 13,8(gam) ; m_{Na_2CO_3} = 0,1.106 = 10,6(gam)$
Đúng 1
Bình luận (0)
Bài 5 : Tính khối lượng của các hỗn hợp sau
d) Hỗn hợp Y gồm 3,36 lít SO2 và 13,44 lít CH4 ở đktc
Bài 6 : Tính thể tích của các hỗn hợp khí sau ở điều kiện tiêu chuẩn
a) 0,15 mol CO2, 0,2 mol NO2, 0,02 mol SO2 và 0,03 mol N2
Bài 5:
\(m_{Y}=m_{SO_2}+m_{CH_4}=\dfrac{3,36}{22,4}.64+\dfrac{13,44}{22,4}.16=19,2(g)\)
Bài 6:
\(V_{CO_2}=0,15.22,4=3,36(l)\\ V_{NO_2}=0,2.22,4=4,48(l)\\ V_{SO_2}=0,02.22,4=0,448(l)\\ V_{N_2}=0,03.22,4=0,672(l)\)
Đúng 0
Bình luận (0)
Hoà tan hoàn toàn 17,6 gam hỗn hợp Fe và Cu vào dung dịch axit H2SO4 đặc nóng, dư. Sau phảnứng thu được 8,96 lit khí SO2 (đo ở đktc) và dung dịch A.a) Tính % khối lượng của mỗi kim loại trong hỗn hợp ban đầu?b) Nếu cho lượng khí SO2 thu được ở trên vào 500 ml dd NaOH 1M. Tính nồng độ mol chất trong ddthu được sau phản ứng? Biết rằng thể tích của dung dịch thay đổi không đáng kể.c) Cho 500 ml dd BaCl2 1M vào dd A. Sau phản ứng thu được m gan kết tủA. Tính m. Biết rằng lượngaxít dư so với phản ứng...
Đọc tiếp
Hoà tan hoàn toàn 17,6 gam hỗn hợp Fe và Cu vào dung dịch axit H2SO4 đặc nóng, dư. Sau phản
ứng thu được 8,96 lit khí SO2 (đo ở đktc) và dung dịch A.
a) Tính % khối lượng của mỗi kim loại trong hỗn hợp ban đầu?
b) Nếu cho lượng khí SO2 thu được ở trên vào 500 ml dd NaOH 1M. Tính nồng độ mol chất trong dd
thu được sau phản ứng? Biết rằng thể tích của dung dịch thay đổi không đáng kể.
c) Cho 500 ml dd BaCl2 1M vào dd A. Sau phản ứng thu được m gan kết tủA. Tính m. Biết rằng lượng
axít dư so với phản ứng là 10%. mọi người giải câu c) dùm em nha các câu trên em làm đc rồi
Thể tích của hỗn hợp A gồm: 0,1 mol O2 ; 0,2 mol H2 và 0,1 mol CO2 ở đktc là
A.
6,72 lit
B.
8,96 lit
C.
22,4 lit
D.
4,48 lit
\(V_{hh}=\left(0,1+0,2+0,1\right).22,4=8,96\left(l\right)\)
Đúng 0
Bình luận (0)
Axit cacboxilic X hai chức (có phần trăm khối lượng của oxi nhỏ hơn 70%), Y và Z là hai ancol đồng đẳng kế tiếp (MYMZ). Đốt cháy hoàn toàn 0,2 mol hỗn hợp gồm X, Y, Z cần vừa đủ 8,96 lít khí O2 (đktc), thu được 7,84 lit khí CO2 (đktc) và 8,1 gam H2O. Phần trăm khối lượng của Y trong hỗn hợp trên là A. 19,5% B.12,6% C. 29,9% D.29,6%
Đọc tiếp
Axit cacboxilic X hai chức (có phần trăm khối lượng của oxi nhỏ hơn 70%), Y và Z là hai ancol đồng đẳng kế tiếp (MY<MZ). Đốt cháy hoàn toàn 0,2 mol hỗn hợp gồm X, Y, Z cần vừa đủ 8,96 lít khí O2 (đktc), thu được 7,84 lit khí CO2 (đktc) và 8,1 gam H2O. Phần trăm khối lượng của Y trong hỗn hợp trên là
A. 19,5%
B.12,6%
C. 29,9%
D.29,6%
Đề 18:1) Khi nung đá vôi ta thu được vôi sống và khí cacbonic. Chất rắn thu được so với chất rắn ban đầu có khối lượng tăng hay giảm? Vì sao ?2) Thể tích của hỗn hợp khí gồm 0,5 mol Co2 và 0,2 mol O2 ở (đktc) là bao nhiêu ?3) 1 mol S có khối lượng là bao nhiêu ?4) 0,25 mol phâ tử N2 ( đktc) có thể tích là bao nhiêu ?5) 1. hãy phát biểu định luật bảo toàn khối lượng ? và giải thích 2. Hãy viết công thức về khối lượng cho phản ứng có 3 chất tham gia và 1 sản phẩm6) Hãy tính khối lượng của hỗn hợp...
Đọc tiếp
Đề 18:
1) Khi nung đá vôi ta thu được vôi sống và khí cacbonic. Chất rắn thu được so với chất rắn ban đầu có khối lượng tăng hay giảm? Vì sao ?
2) Thể tích của hỗn hợp khí gồm 0,5 mol Co2 và 0,2 mol O2 ở (đktc) là bao nhiêu ?
3) 1 mol S có khối lượng là bao nhiêu ?
4) 0,25 mol phâ tử N2 ( đktc) có thể tích là bao nhiêu ?
5) 1. hãy phát biểu định luật bảo toàn khối lượng ? và giải thích
2. Hãy viết công thức về khối lượng cho phản ứng có 3 chất tham gia và 1 sản phẩm
6) Hãy tính khối lượng của hỗn hợp gồm 0,2 mol NaCl và 8,96 lit Co2 ( đktc) ?
7) Tính thể tích của hỗn hợp gồm 1,25 mol khí Co2 ; 1,7 g H2S và 9.10^23 phân tử CO ở đktc?
9) Hợp chất B có khối lượng mol phân tử là 106g. Thành phần các nguyên tố 43,4 % Na; 11,3 % O. Hãy tìm công thức hóa học của B ?
10) . Phản ứng hóa học là gì ?
Đốt cháy 8,96 lit hỗn hợp khí (đktc) gồm CH4, O2 có tỉ khối so với N2 bằng 1.
a. Tính phần trăm thể tích mỗi khí trong hỗn hợp
b. Tính thể tích khí thu được sau phản ứng (đktc)
Giải thích các bước làm nha
a) Gọi số mol CH4, O2 là a, b (mol)
=> \(\left\{{}\begin{matrix}a+b=\dfrac{8,96}{22,4}=0,4\\M=\dfrac{16a+32b}{a+b}=1.28=28\left(g/mol\right)\end{matrix}\right.\)
=> a = 0,1 (mol); b = 0,3 (mol)
\(\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,4}.100\%=25\%\\\%V_{O_2}=\dfrac{0,3}{0,4}.100\%=75\%\end{matrix}\right.\)
b)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,3}{2}\) => CH4 hết, O2 dư
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,1--->0,2-------->0,1
=> VCO2 = 0,1.22,4 = 2,24 (l)
=> VO2(dư) = (0,3 - 0,2).22,4 = 2,24 (l)
=> Vkhí = 2,24 + 2,24 = 4,48 (l)
Đúng 2
Bình luận (5)
Đốt cháy hỗn hợp gồm Al và S trong 8,96 lit O2 (đktc), trong đó có 3,2 gam S cháy hoàn toàn. Tính khối lượng hỗn hợp ban đầu. Al = 27 S = 32 O = 16
nS = 3,2/32 = 0,1 (mol)
nO2 = 8,96/22,4 = 0,4 (mol)
PTHH: S + O2 -> (t°) SO2
Mol: 0,1 ---> 0,1
nO2 (Al) = 0,4 - 0,1 = 0,3 (mol)
PTHH: 4Al + 3O2 -> (t°) 2Al2O3
Mol: 0,4 <--- 0,3
mAl = 0,4 . 27 = 10,8 (g)
mhh = 10,8 + 3,2 = 14 (g)
Đúng 3
Bình luận (1)
nS = 3,2/32 = 0,1 (mol)
nO2 = 8,96/22,4 = 0,4 (mol)
PTHH: S + O2 -> (t°) SO2
Mol: 0,1 ---->0,1
nO (Al) = 0,4 - 0,1 = 0,3 (mol)
PTHH: 4Al + 3O2 -> (t°) 2Al2O3
Mol: 0,4 <--- 0,3
mAl = 0,4 . 27 = 10,8 (g)
mhH = 10,8 + 3,2 = 14 (g)
Đúng 0
Bình luận (0)
Hoà tan hoàn toàn 16,2g hỗn hợp X gồm Cu và Fe bằng lượng dư dung dịch h2so4 đặc nóng thu được dung dịch Y và 8,96 lít khí so2 ( sản phẩm khử duy nhất,đo ở đktc)
a. Tính % theo khối lượng mỗi kim loại trong hỗn hợp X
b. Nếu đem 22g hỗn hợp X nói trên cho tác dụng với lượng dư dung dịch h2so4 loãng thì thể tích khí thu được (đo ở đktc) là bao nhiêu lít ( giả sử hỗn hợp X được trộn đều)
Giúp vs ạ
Đọc tiếp
Hoà tan hoàn toàn 16,2g hỗn hợp X gồm Cu và Fe bằng lượng dư dung dịch h2so4 đặc nóng thu được dung dịch Y và 8,96 lít khí so2 ( sản phẩm khử duy nhất,đo ở đktc) a. Tính % theo khối lượng mỗi kim loại trong hỗn hợp X b. Nếu đem 22g hỗn hợp X nói trên cho tác dụng với lượng dư dung dịch h2so4 loãng thì thể tích khí thu được (đo ở đktc) là bao nhiêu lít ( giả sử hỗn hợp X được trộn đều) Giúp vs ạ
\(n_{Cu}=a\left(mol\right),n_{Fe}=b\left(mol\right)\)
\(m_X=64a+56b=16.2\left(g\right)\left(1\right)\)
\(n_{SO_2}=\dfrac{8.96}{22.4}=0.4\left(mol\right)\)
Bảo toàn e :
\(2a+3b=0.4\cdot2=0.8\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.0475,b=0.235\)
\(\%Cu=\dfrac{0.0475\cdot64}{16.2}\cdot100\%=18.76\%\)
\(\%Fe=81.24\%\)
\(b.\)
\(\dfrac{a}{b}=\dfrac{0.0475}{0.235}=\dfrac{19}{94}\)
\(\Rightarrow n_{Cu}=19x\left(mol\right),n_{Fe}=94x\left(mol\right)\)
\(m_X=19x\cdot64+94x\cdot56=22\left(g\right)\)
\(\Rightarrow x=\dfrac{11}{3240}\)
\(n_{H_2}=n_{Fe}=\dfrac{11}{3240}\cdot94=\dfrac{517}{1620}\left(mol\right)\)
\(V_{H_2}=7.15\left(l\right)\)
Đúng 1
Bình luận (0)