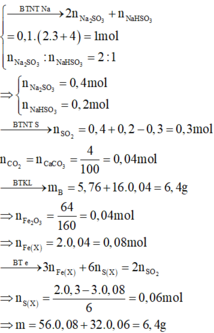Hòa tan hoàn toàn 4 gam hõn hợp Fe và Cu bằng một lượng dư H2SO4 đặc nóng thu được khí A và dung dịch B. Hấp thụ hoàn toàn khí A vào 125 gam dung dịch NaOH, rồi đem cô cạn dung dịch tạo thành được 16,6 gam chất rắn C. Mặt khác cho lượng dư dung dịch NaOH vào dung dịch B, phản ứng xong lọc lấy kết tủa tạo thành, nung đến khối lượng không đổi thu được 5,6 gam chất rắn E. Tính nồng dộ % của dung dịch NaOH đã dùng.

Những câu hỏi liên quan
Hòa tan hoàn toàn m gam FexOy bằng dung dịch H2SO4 đặc nóng dư thu được khí A và dung dịch B. Cho khi A hấp thụ hoàn toàn vào dung dịch NaOH dư tạo ra 12,6 gam muối. Mặt khác, cô cạn dung dịch B thì thu được 120 gam muối khan. Công thức oxit là: A. FeO B. Fe3O4 C. Fe2O3 D. Tất cả đều sai.
Đọc tiếp
Hòa tan hoàn toàn m gam FexOy bằng dung dịch H2SO4 đặc nóng dư thu được khí A và dung dịch B. Cho khi A hấp thụ hoàn toàn vào dung dịch NaOH dư tạo ra 12,6 gam muối. Mặt khác, cô cạn dung dịch B thì thu được 120 gam muối khan. Công thức oxit là:
A. FeO
B. Fe3O4
C. Fe2O3
D. Tất cả đều sai.
Đáp án B
Vì H2SO4 đặc nóng dư nên khí A sinh ra là SO2.
Muối khan thu được là
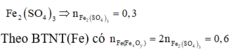
Vì dung dịch NaOH dư nên khỉ dẫn SO2 vào đung dịch NaOH chỉ xảy ra một phản ứng:
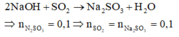
Coi oxit FexOy ban đầu là hỗn hợp của Fe và O.
Gọi nO = a.
Áp dụng định luật bảo toàn moi electron, ta có:

Đúng 0
Bình luận (0)
Hòa tan hoàn toàn m gam FexOy bằng dung dịch H2SO4 đặc nóng dư thu được khí A và dung dịch B. Cho khi A hấp thụ hoàn toàn vào dung dịch NaOH dư tạo ra 12,6 gam muối. Mặt khác, cô cạn dung dịch B thì thu được 120 gam muối khan. Công thức oxit là: A. FeO B. Fe3O4 C. Fe2O3 D. Tất cả đều sai.
Đọc tiếp
Hòa tan hoàn toàn m gam FexOy bằng dung dịch H2SO4 đặc nóng dư thu được khí A và dung dịch B. Cho khi A hấp thụ hoàn toàn vào dung dịch NaOH dư tạo ra 12,6 gam muối. Mặt khác, cô cạn dung dịch B thì thu được 120 gam muối khan. Công thức oxit là:
A. FeO
B. Fe3O4
C. Fe2O3
D. Tất cả đều sai.
hòa tan 24 96 gam trong h2so4 đặc nóng thu được khí so2. hấp thụ hoàn toàn khí so2 vào 1,3 lít dung dịch NaOH 0,7M, sau phản ứng đem cô cạn dung dịch thu được 54,34g chất rắn. xác định kim loại M?
Hòa tan hoàn toàn m (g) FexOy bằng H2SO4 đặc, nóng thu được khí A và dung dịch B. Cho A hấp thụ hoàn toàn bởi NaOH dư tạo 12,6g muối. Cô cạn dung dịch B thu được 120g muối khan. Xác định công thức của oxit sắt.
2FexOy+(6x-2y)H2SO4-------->xFe2(SO4)3+(3x-2y)SO2+(6x-2y)H2O (1) nNa2SO3=12.6/126=0.1molmuối khan chính là Fe2(SO4)3nFe2(SO4)3=120/400=0.3molđược 2 số mol ta đưa lên pt (1) lập tỉ lệ x/yx/(3x-2y)=0.3/0.1<=>x/y=3/4CT:Fe3O4
Đúng 0
Bình luận (0)
2FexOy+(6x-2y)H2SO4--->xFe2(SO4)3+(3x-2y)SO2+ (6x-2y)H2O
nFe2(SO4)3=120/400=0,3mol-->nFe=0,6mol
nSO2=nNa2SO3=0,1mol
bảo toàn nguyên tố S
->nH2SO4= 0,3.3+0,1=1mol=nH2O
bảo toàn nguyên tố O
-> y+4.1 = 0,3.4.3 +0,1.2+1
-->y=0,8
vậy x/y=0,6/0,8=3/4
vậy oxit là Fe3O4
Đúng 0
Bình luận (0)
Hòa tan 12,6 gam hỗn hợp hai kim loại M (hóa trị II) và M’ (hóa trị III) bằng axit HCl dư, thu được dung dịch A và khí B. Đốt cháy hoàn toàn ½ lượng khí B trên thu được 2,79 gam H2O. a) Cô cạn dung dịch A thu được m gam hỗn hợp muối khan. Tính giá trị m. b) Cho lượng khí B còn lại phản ứng hoàn toàn với khí Cl2 vừa đủ (t0C) rồi cho sản phẩm thu được hấp thụ vào 0,2 lít dung dịch NaOH 16% (d 1,20g/ml). Tính nồng độ % các chất trong dung dịch thu được.
Đọc tiếp
Hòa tan 12,6 gam hỗn hợp hai kim loại M (hóa trị II) và M’ (hóa trị III) bằng axit HCl dư, thu được dung dịch A và khí B. Đốt cháy hoàn toàn ½ lượng khí B trên thu được 2,79 gam H2O.
a) Cô cạn dung dịch A thu được m gam hỗn hợp muối khan. Tính giá trị m.
b) Cho lượng khí B còn lại phản ứng hoàn toàn với khí Cl2 vừa đủ (t0C) rồi cho sản phẩm thu được hấp thụ vào 0,2 lít dung dịch NaOH 16% (d = 1,20g/ml). Tính nồng độ % các chất trong dung dịch thu được.
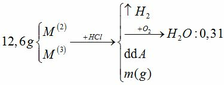
Đồng nhất dữ kiện để thuận lợi cho tính toán, bằng cách nhân đôi khối lượng H2O.
a.
BTNT H: nH2 = nH2O = 0,31 mol
=> nHCl = 0,62mol
BTKL: m kim loại + mHCl = mA + mB => 12,6 + 36,5 . 0,62 = m + 2 . 0,31 => m = 34,61g
b.
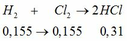
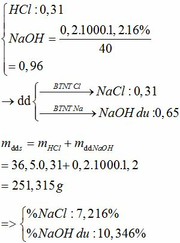
Đúng 0
Bình luận (0)
Hoàn tan 6,72 gam kim loại M trong H 2 S O 4 đặc nóng dư, thu được khí S O 2 . Cho khí này hấp thụ hoàn toàn trong 2 lít dung dịch NaOH 0,18 M, sau phản ứng đem cô cạn dung dịch thu được 22,68 gam chất rắn. M là kim loại
A. Cu
B. Mg
C. Fe
D. Ca
Hòa tan hết m gam hỗn hợp X gồm FeS2, FeS và Fe bằng dung dịch H2SO4 đặc nóng dư thu được dung dịch Y và khí Z. Hấp thụ hết Z vào 100ml dung dịch hỗn hợp Na2SO3 3M và NaOH 4M thu được dung dịch A chứa hai muối Na2SO3 và NaHSO3 với tỉ lệ mol 2 : 1. Cho Y tác dụng với dung dịch NaOH dư, lọc kết tủa nung đến khối lượng không đổi thu được chất rắn B. Cho khí CO đi qua ống sứ chứa toàn bộ chất rắn B, nung nóng thu được 5,76 gam hỗn hợp D gồm Fe và các oxit của Fe. Hấp thụ hết khí sinh ra vào bình chứ...
Đọc tiếp
Hòa tan hết m gam hỗn hợp X gồm FeS2, FeS và Fe bằng dung dịch H2SO4 đặc nóng dư thu được dung dịch Y và khí Z. Hấp thụ hết Z vào 100ml dung dịch hỗn hợp Na2SO3 3M và NaOH 4M thu được dung dịch A chứa hai muối Na2SO3 và NaHSO3 với tỉ lệ mol 2 : 1. Cho Y tác dụng với dung dịch NaOH dư, lọc kết tủa nung đến khối lượng không đổi thu được chất rắn B. Cho khí CO đi qua ống sứ chứa toàn bộ chất rắn B, nung nóng thu được 5,76 gam hỗn hợp D gồm Fe và các oxit của Fe. Hấp thụ hết khí sinh ra vào bình chứa dung dịch Ca(OH)2 dư thì thu được 4 gam kết tủa. Các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 6,40
B. 7,28
C. 7,04
D. 6,72
Hoà tan 19,2 gam kim loại M trong H 2 S O 4 đặc nóng dư, thu được khí S O 2 . Cho khí này hấp thụ hoàn toàn trong 1 lít dung dịch NaOH 0,6M, sau phản ứng đem cô cạn dung dịch thu được 37,8 gam chất rắn. M là kim loại
A. Cu
B. Mg
C. Fe
D. Ca
Hỗn hợp X gồm Al , fe và Cu. chia a gam X thành 3 phần bằng nhau
- Phần 1 cho tác dụng vào lượng dư dung dịch HCl thì thu được 5,6 lit khí H2
- phần 2 hòa tan hoàn toàn bằng lượng dư dung dịch H2SO4 đặc đun nóng thì thu được 7,84 lít khí SO2 (sản phẩm khử duy nhất) ,dung dịch y và chất rắn Z. Cho y tác dụng với lượng dư dung dịch NaOH thu được kết tủa T. Lọc lấy T đem nung trong không khí đến khối lượng không đổi thì thu được 12 g rắn G
- phần 3 đốt cháy trong bình có chứa lượng dư khí Clo thu...
Đọc tiếp
Hỗn hợp X gồm Al , fe và Cu. chia a gam X thành 3 phần bằng nhau - Phần 1 cho tác dụng vào lượng dư dung dịch HCl thì thu được 5,6 lit khí H2 - phần 2 hòa tan hoàn toàn bằng lượng dư dung dịch H2SO4 đặc đun nóng thì thu được 7,84 lít khí SO2 (sản phẩm khử duy nhất) ,dung dịch y và chất rắn Z. Cho y tác dụng với lượng dư dung dịch NaOH thu được kết tủa T. Lọc lấy T đem nung trong không khí đến khối lượng không đổi thì thu được 12 g rắn G - phần 3 đốt cháy trong bình có chứa lượng dư khí Clo thu được b gam chất rắn E biết các phản ứng xảy ra hoàn toàn. Tính giá trị của a và b Làm hộ em với ạ!!!。゚( ゚^∀^゚)゚。
Hòa tan hoàn toàn 8,0 gam hỗn hợp A gồm Cu và Fe3O4 bằng dung dịch H2SO4 thì thu được dung dịch B và 0,4 gam chất rắn K không tan. Cô cạn dung dịch B thì thu được 17,2 gam muốiMặt khác hòa tan hoàn toàn 8,0 gam hỗn hợp A trên bằng lượng dư dung dịch H2SO4 đặc, đun nóng thì thu được khí SO2 ( sản phẩm khử duy nhất ). Hấp thụ hoàn toàn lượng khí SO2 sinh ra vào 40 ml dung dịch KMnO4 1,0M thu được dung dịch Da. Viết PTHH các phản ứng xảy rab. Tính khối lượng của từng muối có trong Bc. Tính nồng độ...
Đọc tiếp
Hòa tan hoàn toàn 8,0 gam hỗn hợp A gồm Cu và Fe3O4 bằng dung dịch H2SO4 thì thu được dung dịch B và 0,4 gam chất rắn K không tan. Cô cạn dung dịch B thì thu được 17,2 gam muối
Mặt khác hòa tan hoàn toàn 8,0 gam hỗn hợp A trên bằng lượng dư dung dịch H2SO4 đặc, đun nóng thì thu được khí SO2 ( sản phẩm khử duy nhất ). Hấp thụ hoàn toàn lượng khí SO2 sinh ra vào 40 ml dung dịch KMnO4 1,0M thu được dung dịch D
a. Viết PTHH các phản ứng xảy ra
b. Tính khối lượng của từng muối có trong B
c. Tính nồng độ mol của các chất tan có trong D, biết thể tích dung dịch thay đổi không đáng kể
a, \(Fe_3O_4+4H_2SO_4\rightarrow FeSO_4+Fe_2\left(SO_4\right)_3+4H_2O\) (1)
\(Cu+Fe_2\left(SO_4\right)_3\rightarrow CuSO_4+2FeSO_4\) (2)
\(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O\) (3)
\(2Fe_3O_4+10H_2SO_{4\left(đ\right)}\underrightarrow{t^o}3Fe_2\left(SO_4\right)_3+SO_2+10H_2O\) (4)
\(5SO_2+2KMnO_4+2H_2O\rightarrow2MnSO_4+K_2SO_4+2H_2SO_4\) (5)
b, - K là Fe3O4 dư. → mFe3O4 (dư) = 0,4 (g)
- B gồm: CuSO4, FeSO4 và Fe2(SO4)3.
Gọi: số mol Cu, Fe3O4 pư với H2SO4 loãng lần lượt là: x, y (mol)
⇒ 64x + 232y = 8 - 0,4 (1)
Theo PT: \(\left\{{}\begin{matrix}n_{FeSO_4\left(1\right)}=n_{Fe_2\left(SO_4\right)_3\left(1\right)}=n_{Fe_3O_4}=y\left(mol\right)\\n_{CuSO_4}=n_{Fe_2\left(SO_4\right)_3\left(2\right)}=n_{Cu}=x\left(mol\right)\\n_{FeSO_4\left(2\right)}=2n_{Cu}=2x\left(mol\right)\end{matrix}\right.\)
→ Trong B có: CuSO4: x (mol), FeSO4: y + 2x (mol) và Fe2(SO4)3: y - x (mol)
⇒ 160x + 152(y+2x) + 400(y-x) = 17,2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,01\left(mol\right)\\y=0,03\left(mol\right)\end{matrix}\right.\)
⇒ mCuSO4 = 0,01.160 =1,6 (g)
mFeSO4 = (0,03+2.0,01).152 = 7,6 (g)
mFe2(SO4)3 = (0,03-0,01).400 = 8 (g)
c, Trong 8 (g) hh có Cu: 0,01 (mol) và Fe3O4: 0,03 + 0,4/232 = 23/725 (mol)
Theo PT: \(n_{SO_2}=n_{Cu}+\dfrac{1}{2}n_{Fe_3O_4}\approx0,026\left(mol\right)\)
\(n_{KMnO_4}=0,04.1=0,04\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,026}{5}< \dfrac{0,04}{2}\), ta được KMnO4 dư.
Theo PT: \(\left\{{}\begin{matrix}n_{KMnO_4\left(pư\right)}=n_{MnSO_4}=n_{H_2SO_4}=\dfrac{2}{5}n_{SO_2}=0,0104\left(mol\right)\\n_{K_2SO_4}=\dfrac{1}{5}n_{SO_2}=0,0052\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{KMnO_4\left(dư\right)}=0,04-0,0104=0,0296\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{KMnO_4}\left(dư\right)}=\dfrac{0,0296}{0,04}=0,74\left(M\right)\\C_{M_{MnSO_4}}=C_{M_{H_2SO_4}}=\dfrac{0,0104}{0,04}=0,26\left(M\right)\\C_{M_{K_2SO_4}}=\dfrac{0,0052}{0,04}=0,13\left(M\right)\end{matrix}\right.\)
Đúng 3
Bình luận (0)