nhận biết các dung dịch băng pthh h2so4 , koh , kno3 , hcl
Nhận biết các chất sau:
a/ 3 dung dịch: HCl, KOH, Na2SO4
b/ 3 dung dịch: H3PO4, Ba(OH)2, BaCl2
c/ 4 dung dịch: NaCl, H2SO4, KNO3, NaOH
a) Cho thử QT:
- Hoá xanh: KOH
- Hoá đỏ: HCl
- Không chuyển màu: Na2SO4
b) Cho thử QT:
- Hoá xanh: Ba(OH)2
- Hoá đỏ: H3PO4
- Không chuyển màu: BaCl2
c) Cho thử QT:
- Hoá xanh: NaOH
- Hoá đỏ: H2SO4
- Không chuyển màu: NaCl, KNO3 (1)
Cho (1) tác dụng với dd AgNO3:
- Có kết tủa màu trắng: NaCl
\(NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)
- Không hiện tượng: KNO3
a.Đưa quỳ tím vào 3 dd:
-HCl: quỳ hóa đỏ
-KOH: quỳ hóa xanh
-Na2SO4: quỳ không chuyển màu
b.Đưa quỳ tím vào 3 dd:
-H3PO4: quỳ hóa đỏ
-Ba(OH)2: quỳ hóa xanh
-BaCl2: quỳ không chuyển màu
Trình bày các phương pháp hóa học để nhận biết các dung dịch sau:
a)KOH,KNO3,Ba(OH)2.
b)KOH,HCl,H2SO4.
c)NaOH,NaNO3,Ba(OH)2.
a, - Trích mẫu thử.
- Nhỏ vài giọt từng mẫu thử vào giấy quỳ tím.
+ Quỳ tím hóa xanh: KOH, Ba(OH)2. (1)
+ Quỳ tím không đổi màu: KNO3
- Cho mẫu thử nhóm (1) pư với dd K2SO4.
+ Xuất hiện kết tủa trắng: Ba(OH)2.
PT: \(K_2SO_4+Ba\left(OH\right)_2\rightarrow2KOH+BaSO_{4\downarrow}\)
+ Không hiện tượng: KOH.
- Dán nhãn.
b, - Trích mẫu thử.
- Nhỏ vài giọt từng mẫu thử vào giấy quỳ tím.
+ Quỳ tím hóa đỏ: HCl, H2SO4. (1)
+ Quỳ tím hóa xanh: KOH.
- Cho mẫu thử nhóm (1) pư với dd BaCl2.
+ Xuất hiện kết tủa trắng: H2SO4.
PT: \(BaCl_2+H_2SO_4\rightarrow2HCl+BaSO_{4\downarrow}\)
+ Không hiện tượng: HCl.
- Dán nhãn.
c, - Trích mẫu thử.
- Nhỏ vài giọt từng mẫu thử vào giấy quỳ tím.
+ Quỳ tím hóa xanh: NaOH, Ba(OH)2. (1)
+ Quỳ tím không đổi màu: NaNO3.
- Cho mẫu thử nhóm (1) pư với dd Na2SO4.
+ Xuất hiện kết tủa trắng: Ba(OH)2.
PT: \(Ba\left(OH\right)_2+Na_2SO_4\rightarrow2NaOH+BaSO_{4\downarrow}\)
+ Không hiện tượng: NaOH.
- Dán nhãn.
Trình bày phương pháp hóa học để nhận biết các dung dịch không màu,riêng biệt sau:
a)HNO3,KOH,H2SO4,KNO3
b)HCl,NaOH,H2SO4,NaCl
a, - Trích mẫu thử.
- Nhỏ từng mẫu thử vào quỳ tím.
+ Quỳ hóa đỏ: HNO3, H2SO4 (1)
+ Quỳ hóa xanh: KOH
+ Quỳ không đổi màu: KNO3
- Cho mẫu thử nhóm (1) pư với dd BaCl2
+ Có tủa trắng: H2SO4
PT: \(BaCl_2+H_2SO_4\rightarrow2HCl+BaSO_4\)
+ Không hiện tượng: HNO3
- Dán nhãn.
b, - Trích mẫu thử.
- Nhỏ từng mẫu thử vào quỳ tím.
+ Quỳ hóa đỏ: HCl, H2SO4 (1)
+ Quỳ hóa xanh: NaOH
+ Quỳ không đổi màu: NaCl
- Cho mẫu thử nhóm (1) pư với dd BaCl2
+ Có tủa trắng: H2SO4
PT: \(H_2SO_4+BaCl_2\rightarrow2HCl+BaSO_4\)
+ Không hiện tượng: HCl
- Dán nhãn.
Nhận biết các dung dịch đựng trong các lọ mất nhạn bằng phương pháp hóa học :
a) HCL , KOH , H2SO4 , KNO3
b) Ca(OH)2 , NaOH , HCL , NaCl
c) H2SO4 , NaCl , KOH , Na2SO4
d) HCL , KOH , H2SO4 , KNO3
Phần a
Lấy mẫu thử của 4 ddịch:
Dùng quỳ tím để phân biệt 4 mẫu thử:
Mẫu thử làm xanh màu quỳ tím là KOH, các chất khác không đổi màu quỳ tím
Dùng dd BaCl2 để phân biệt 3 mẫu thử:
+Mẫu thử xuất hiện kết tủa trắng là dd K2S04
K2S04+BaCl2=>BaS04+2KCl
+Mẫu thử không hiện tượng là dd KCl,KN03
Dùng dd AgN03 để phân biệt 2 mẫu thử còn lại:
+Mẫu thử xuất hiện kết tủa trắng là dd KCl
AgN03+KCl=>AgCl+KN03
+Mẫu thử không hiện tượng là dd KN03
Sử dụng thêm một thuốc thử để nhận biết 6 ống nghiệm không dán nhãn, mỗi ống nghiệm chứa một trong các dung dịch sau: HCl, H2SO4, KNO3, KOH, BaCl2, K2SO4. Viết các phương trình phản ứng xảy ra.
Xử lí bài tập nhận biết, ta chỉ cần thử 1 trong 5 hóa chất hữu dụng sau: Ba(OH)2, H2SO4, AgNO3, Quì tím, HCl. Trích mỗi ống nghiệm ra làm nhiều mẫu thử, đánh số thứ tự để thuận tiện đối chiếu kết quả thực nghiệm.
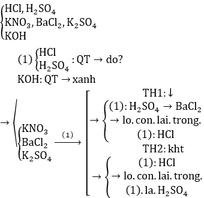
Lấy ngẫu nhiên 1 lọ thuộc nhóm (1) (nhóm axit) để nhận biết nhóm (2)
Dùng BaCl2 nhận biết KNO3 và K2SO4
Pt: BaCl2 + H2SO4 → 2HCl + BaSO4↓
BaCl2 + K2SO4 → 2KCl + BaSO4↓
Câu 1. : Dùng các phương pháp hóa học ,em hãy nhận biết các lọ chứa dung dịch không màu sau ( Viết PTHH nếu có) :
a/ KOH , NaCl , NaNO3 b/ H2SO4 , NaOH , HCl
`a) KOH (B), NaCl (M), NaNO_3(M)`
`-` Trích mẫu thử
`-` Nhỏ lần lượt các mẫu thử lên giấy quỳ tím
`+` Quỳ tím hóa xanh `-> KOH` (nhận)
`+` Quỳ tím không đổi màu `-> NaCl, NaNO_3` `(1)`
`-` Lần lượt cho dung dịch `AgNO_3` vào `2` mẫu thử ở nhóm `(1)`
`+` Xuất hiện kết tủa màu trắng `-> NaCl`
`PT: NaCl + AgNO_3 -> NaNO_3 + AgCl`
`+` Không có hiện tượng `-> NaNO_3`.
`b) H_2SO_4 (A), NaOH (B), HCl (A)`
`-` Trích mẫu thử
`-` Nhỏ lần lượt các mẫu thử lên giấy quỳ tím
`+` Quỳ tím hóa đỏ `-> H_2SO_4, HCl` `(1)`
`+` Quỳ tím hóa xanh `-> NaOH` (nhận)
`-` Lần lượt cho dung dịch `BaCl_2` vào `2` mẫu thử ở nhóm `(1)`
`+` Xuất hiện kết tủa màu trắng `-> H_2SO_4`
`PT: H_2SO_4 + BaCl_2 -> BaSO_4 + 2HCl`
`+` Không có hiện tượng `-> HCl`.
Cho 5 lọ dung dịch mất nhãn như sau : Ba(OH)2,KNO3,HCl,H2SO4,K2SO4.Dùng phương pháp hóa học để nhận bt các lọ trên.Viết PTHH nếu có
Trích mẫu thử, cho quỳ tím vào các mẫu thử:
- Hóa đỏ: \(HCl,H_2SO_4\)
- Hóa xanh: \(Ba(OH)_2\)
- Ko đổi màu: \(KNO_3,K_2SO_4\)
Cho dd \(BaCl_2\) vào dd làm quỳ hóa đỏ:
- Tạo KT trắng: \(H_2SO_4\)
- Ko ht: \(HCl\)
Cho tiếp dd \(BaCl_2\) vào dd làm quỳ ko đổi màu:
- Tạo KT trắng: \(K_2SO_4\)
- Ko ht: \(KNO_3\)
\(BaCl_2+H_2SO_4\to BaSO_4\downarrow+2HCl\\ BaCl_2+K_2SO_4\to BaSO_4\downarrow+2KCl\)
- Cho các dd tác dụng với quỳ tím
+ QT chuyển đỏ: HCl, H2SO4 (1)
+ QT chuyển xanh: Ba(OH)2
+ QT không chuyển màu: KNO3, K2SO4 (2)
- Cho Ba(OH)2 tác dụng với các dung dịch ở (1)
+ Kết tủa trắng: H2SO4
Ba(OH)2 + H2SO4 --> BaSO4\(\downarrow\) + 2H2O
+ Không hiện tượng: HCl
Ba(OH)2 + 2HCl --> BaCl2 + 2H2O
- Cho dd ở (2) tác dụng với dd Ba(OH)2
+ Kết tủa trắng: K2SO4
K2SO4 + Ba(OH)2 --> BaSO4\(\downarrow\) + 2KOH
+ Không hiện tượng: KNO3
trình bày phương pháp hóa học để nhận biết các dung dịch
a)NaCl,H2SO4,Na2SO4
b)HCL,KNO3,K2SO4
c)H2SO4,NaOH,NaCl và Na2SO4
d)KOH,K2SO4,KNO3,H2SO4
a) dùng quỳ tím nhận H2SO4 , sau đó dùng muối AgNO3 nhận NaCl
NaCl + AgNO3 → NaNO3 + AgCl ↓
b) dùng quỳ tím nhận HCl, sau đó dùng muối BaCl2 nhận K2SO4
BaCl2 + K2SO4 → KCl + BaSO4 ↓
c)dùng quỳ tím nhận H2SO4, NaOH sau đó dùng muối BaCl2 nhận Na2SO4
d) dùng quỳ tím nhận KOH, H2SO4 sau đó dùng muối BaCl2 nhận K2SO4
a) trích mẫu thử:
cho các dung dịch đó thử với quỳ tím:
Nhóm 1: quỳ tím hóa đỏ: H2SO4
Nhóm 2: quỳ tím không đổi màu: Na2SO4, NaCl
Cho nhóm 2 tác dụng với dung dịch BaCl2. Nếu có xuất hiện kết tủa là BaSO4 chất ban đầu là Na2SO4, chất còn lại là NaCl
PTHH: Na2SO4 + BaCl2 tạo ra BaSO4 + 2NaCl
b) Trích mẫu thử:
Cho các dung dịch đó thử với quỳ tím:
Nhóm 1: quỳ tím hóa đỏ: HCl
Nhóm 2: quỳ tím không đổi màu KNO3, K2SO4
Cho Nhóm 2 tác dụng với Ba(OH)2 nếu có xuất hiện kết tủa là BaSO4 chất ban đầu là K2SO4, chất còn lại là KNO3
PTHH: K2SO4 + Ba(OH)2 tạo ra BaSO4 + 2KOH
c) Trích mẫu thử:
Cho các dung dịch đó thử với quỳ tím
Nhóm 1: Quỳ tím hóa đỏ: H2SO4
Nhóm 2: quỳ tím không đổi màu: NaOH, NaCl, Na2SO4
Cho nhóm 2 tác dụng với BaCl2 nếu có xuất hiện kết tủa là BaSo4 chất ban đầu là Na2So4, còn lại NaOH và NaCl.
PTHH: Na2So4 + BaCl2 tạo ra BaSO4 + 2NaCl
Cho NaOH và NaCl tác dụng với AgNO3 nếu có xuất hiện kết tủa là AgCl chất ban đầu là NaCl, còn lại là NaOH.
PTHH: NaCl + AgNO3 tạo ra AgCl + NaNO3
d) Trích mẫu thử:
Cho các dung dịch thử với quỳ tím
Nhóm 1: quỳ tím hóa đỏ: H2SO4
Nhóm 2: quỳ tím hóa xanh: KOH
Nhóm 3: quỳ tím không đổi màu: K2SO4, KNO3
Cho nhóm 3 tác dụng với BaCl2 nếu có xuất hiện kết tủa là BaSO4 chất ban đầu là K2SO4, chất còn lại là KNO3.
PTHH: K2SO4 + BaCl2 tạo ra 2KCl + BaSO4
* có cân bằng giùm rồi, mong nó sẽ giúp ích cho bạn*
a) Các axit : HCl, HNO3, HI, H2SO4, HClO4, HClO, HF, H2SO3, H2CO3, H3PO4, CH3COOH, HNO2. Nhận xét về dung dịch axit?
b) Các bazơ : NaOH, KOH, Ca(OH)2, Ba(OH)2, CsOH. Nhận xét về dung dịch bazơ?
d) Các muối : NaCl, KNO3, (NH4)2SO4, FeCl3, MgSO4, Al2(SO4)3, Ba(NO3)2, K3PO4 , NaClO, KClO3. Nhận xét về dung dịch muối?
e) Các muối : NaHSO4, KHCO3 , NaH2PO4, K2HPO4 , NaHS.
Trong các chất trên, chất nào là chất điện li mạnh, chất nào là chất điện li yếu?
Nêu khái niệm : axit, bazơ, muối , hiđroxit lưỡng tính theo thuyết điện li?